FDA
Transcenta的TST001获FDA孤儿药认定
7月28日,TranscentaHolding Limited的TST001获FDA孤儿药认定,用于治疗胃癌或者胃食管交界处癌(GC/GEJ)。
点击查看:
http://www.transcenta.com/newsDet/id-59
Arrowhead Pharmaceuticals的ARO-AAT获FDA突破性治疗认定
7月29日,ArrowheadPharmaceuticals, Inc.的ARO-AAT获FDA突破性治疗认定,用于治疗与α-1 抗胰蛋白酶缺乏症(AATD)相关的罕见型遗传性肝病。
中美双报、新药注册,尽在奥来恩!
Mycovia Pharmaceuticals的OTESECONAZOLE获FDA优先审评认定
7月28日,MycoviaPharmaceuticals, Inc.的Oteseconazole获FDA优先审评认定,用于治疗复发性外阴阴道念珠菌病(RVVC)。

点击查看:
https://static1.squarespace.com/static/5ab958c5e749401d7a2ed988/t/61008a49003cdb5936823cc3/1627425353834/Mycovia+Oteseconazole+NDA+acceptance+release_+7.27.21_MLR+approved_FINAL.pdf
ERYTECH Pharma的ERYASPASE获FDA快速通道认定
7月29日,ERYTECHPharma的Eryaspase获FDA快速通道认定,用于治疗已经对大肠杆菌衍生的聚乙二醇化天冬酰胺酶产生超敏反应的急性淋巴细胞白血病患者。

点击查看:
https://erytech.com/wp-content/uploads/ERYTECH_PR_FDA_FastTrack_ALL_EN_vf.pdf
NMPA
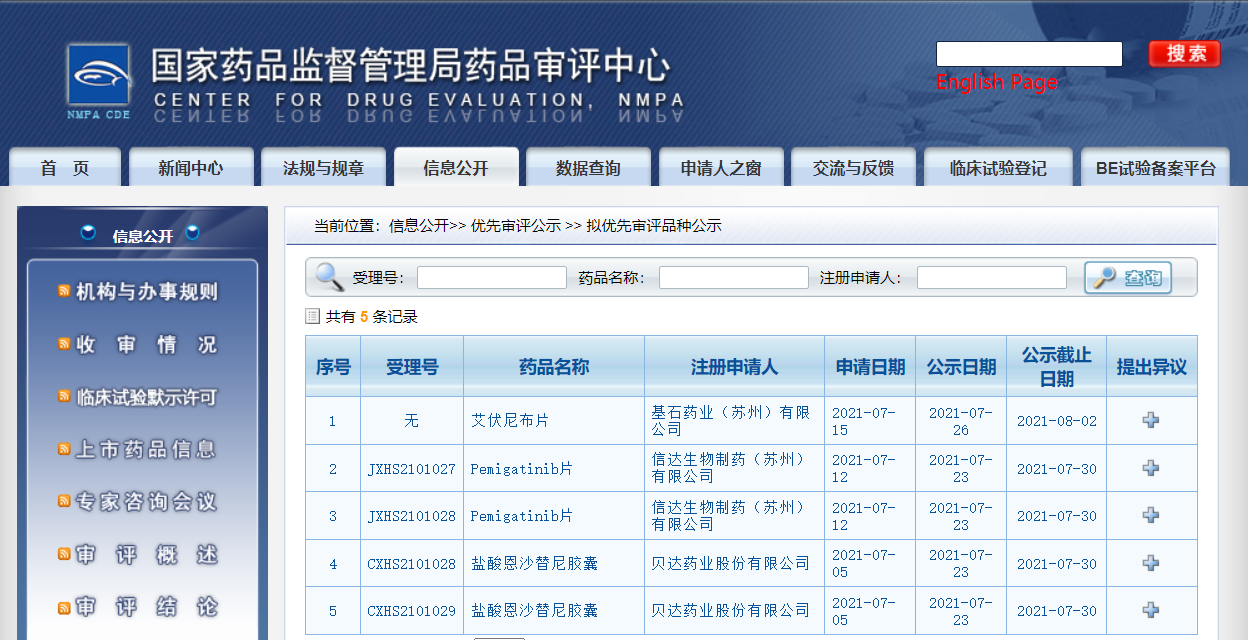
三款药物纳入拟优先审评品种
近日,CDE信息公示,三款药物纳入拟优先审评品种:
1. 贝达药业股份有限公司的盐酸恩莎替尼胶囊,拟用于治疗此前接受过克唑替尼治疗后进展的或者对克唑替尼不耐受的间变性淋巴瘤激酶(ALK)阳性的局部晚期或转移性非小细胞肺癌(NSCLC)患者;
2. 信达生物制药(苏州)有限公司的Pemigatinib片,拟用于治疗既往至少接受过一种系统性治疗,且经检测确认存在有FGFR2融合或重排的晚期、转移性或不可手术切除的胆管癌成人患者;
3. 基石药业(苏州)有限公司的艾伏尼布片,拟用于治疗携带易感IDH1突变的成人复发性或难治性急性髓系白血病。
点击查看:
http://www.cde.org.cn/news.do?method=changePage&pageName=service&frameStr=21#


