第17期 / 本文由奥来恩团队原创
生物类似药(Biosimilar)通常被看作是小分子化学仿制药的生物版本。但是,二者之间存在显著的差异。与化学小分子药物相比,生物类似药通常分子量很大,相对来说也不稳定;它们通常由活细胞培养物制成,结构复杂且具有异质性,无法充分表征,产品质量与生产工艺关系密切。
美国化学仿制药市场已十分成熟,而生物类似药的市场仍有非常大的增长空间。尽管美国在2017年全球所有生物药品销售份额中占比高达59%,其生物类似药销售份额仅占全球生物类似药的2%。
中美双报_FDA IND/NDA/BLA_新药注册-奥来恩医药
生物类似药大多是一种基于蛋白质的治疗药物,与其参考的已上市的生物制品(参照药)高度相似,且在安全性、有效性、质量或生物活性方面未显示出有临床意义的差异。与化学仿制药不同的是,生物类似药与其参照药或其他已获批的同样基于该参照药的生物类似药并不完全相同,因为它们使用了不同的表达体系(细胞系)进行开发,并且生产与纯化工艺也不同。本期《奥来恩专家解读》将简要介绍美国FDA对生物类似药申报与研发的相关法规要求,旨在为药企生物类似药的研发提供一些参考建议。

FDA对生物类似药的展望。来源:FDA官网
01.FDA如何定义生物类似药?
由于生物类似药的性质复杂,定义生物类似药并不像定义化学仿制药那么简单明确。FDA将生物类似药定义为一种除某些非活性成分存在细微差异外、与其参照药(Reference Product)高度相似的生物制品,并且生物类似药与其参照药在安全性、纯度与效价方面不存在有临床意义的差异。
02.FDA如何评估生物类似药的相似性?
FDA根据以下数据进行证据整体性方法(Totality-of-the-Evidence Approach)综合评价,以确定候选生物制品是否与其参照药具有生物相似性:
• CMC分析实验数据:证明生物制品除某些非活性成分存在细微差异外、与参照药高度相似;
• 动物研究数据(包括毒性的评估);
• 充分的临床试验或研究数据(包括免疫原性和药代动力学(PK)或药效动力学(PD)评估):证明该生物制品在一种或多种情形下(其参照药已在该方面获得许可并计划使用)使用的安全性、纯度和效价。
03.如何证明生物类似药的生物相似性并使其获批?
FDA建议采用逐步渐进式方法(Stepwise Approach)来评价生物类似药的属性。在每个步骤中,FDA建议申请人评估其拟申报产品在生物相似性阐明中残存的不确定性的程度,并明确解决该不确定性的后续步骤。这种逐步渐进式方法包括:
• 第1步:CMC研究
按照上述原则,对生物类似药与其参照药进行广泛的结构和功能特性鉴定是生物类似药研发项目的基础。
• 第2步:非临床研究
在经过广泛的结构和功能特性鉴定后,生物类似药的安全性仍残存不确定性时,考虑动物数据在评估蛋白质药品中的作用。如果已经通过分析表征证明生物类似药与参照药高度相似,则有可能无需实施非临床研究。
• 第3步:临床研究
要求在适当的研究人群中开展两种药品的人体PK和 PD以及临床免疫原性的对照研究。
• 第4步:在实施上述包含结构分析、功能评价、动物试验、人体PK和PD研究以及临床免疫原性评估的三个步骤后,仍需要获得其他安全性和有效性的对照研究数据以充分解决关于生物相似性中残存的其他不确定性问题。
04.生物类似药的开发有何特点?
下图总结并比较了生物原创药与生物类似药的开发过程的区别。左边的反向三角形描述了原创生物药品的研发和批准途径。图中可见,为评估生物药品安全性与有效性进行的完整的临床研究需要的资源和时间,远远超过生物药品的CMC分析表征研究。相反,右侧三角形表明生物类似药开发始于用于证明其与参照药具有生物相似性的CMC分析数据,这是生物类似药开发的基础。FDA采用证据整体性方法证实生物相似性,包括CMC详细分析(结构和功能表征)、非临床评价(动物研究)、临床药理学(PK/PD数据)、临床免疫原性数据以及其他临床对照研究。对于生物类似药项目,其目的是证明拟申报产品与已上市参照药的生物相似性。
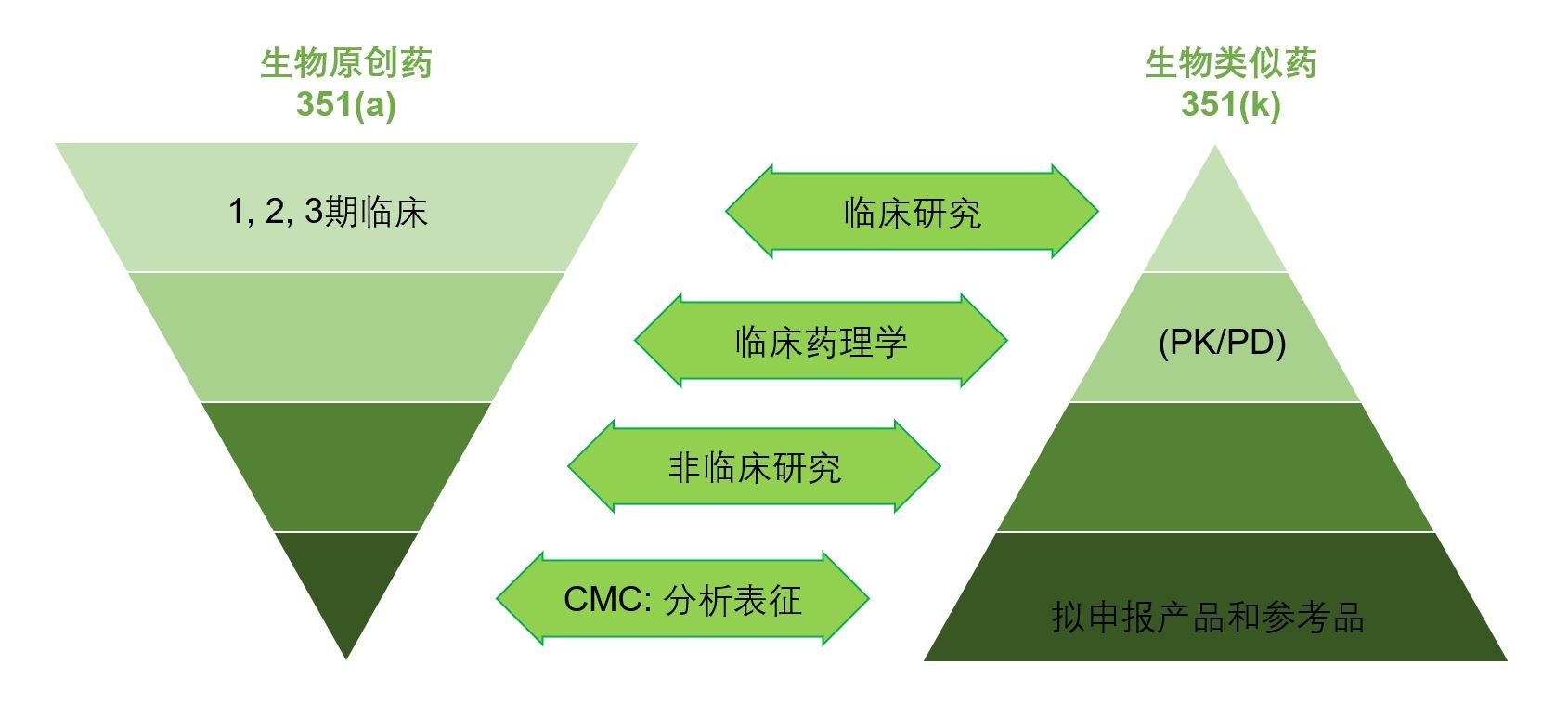
生物原创药与生物类似药开发过程的区别。来源:奥来恩医药
我们将在下一篇关于生物类似药的《奥来恩专家解读》中介绍在美国进行生物类似药IND申请的相关要点,敬请关注!
05.奥来恩如何帮助您成功获批生物类似药?
奥来恩作为专业化的新药法规咨询与注册团队,凭借多年的FDA、NMPA及其他主要国际市场的药政法规与注册专长,包括多个准备和申请FDA IND、NDA/BLA、加快通道认定(快速通道认定、突破性治疗认定和优先审评)和孤儿药认定的成功经验,为您提供差距分析、申请策略规划、资料准备以及与FDA的有效沟通交流,助力加快您的新药研发并早日成功获批、造福患者。
信息来源:
[1]. FDA Guidance: Scientific Considerations inDemonstrating Biosimilarity to a Reference Product (April 2015).
[2]. International Generic andBiosimilar medicines Association (IGBA). 2018. “Building on the Experience andSuccess of Biosimilar Medicines.” February 1.
[3]. 2017 Generic Drug Access andSavings in the U.S. Report.
[4]. Development of Therapeutic ProteinBiosimilars: Comparative Analytical Assessment and Other Quality-RelatedConsiderations (May 2019).


