第20期 / 本文由奥来恩团队原创
CMC全称Chemistry,Manufacturing and Controls, 即(药物的)化学成分、生产制造和质量控制。CMC主要包括原料药(Drug Substance)和制剂(Drug Product)两大部分,药品的生产过程、生产厂商、生产过程中的质量控制、原料药的表征、分析方法及其验证以及稳定性研究都包含其中。
上一期《奥来恩专家解读》(详见第19期)简要介绍了美国FDA对IND申请CMC部分的相关要求。本期我们为您详细介绍CMC部分在IND申报文件中的呈现形式与CMC各章节内容。

来源:DCAT官网
01.在美国IND申报资料中,哪些CMC资料是需要提供的?
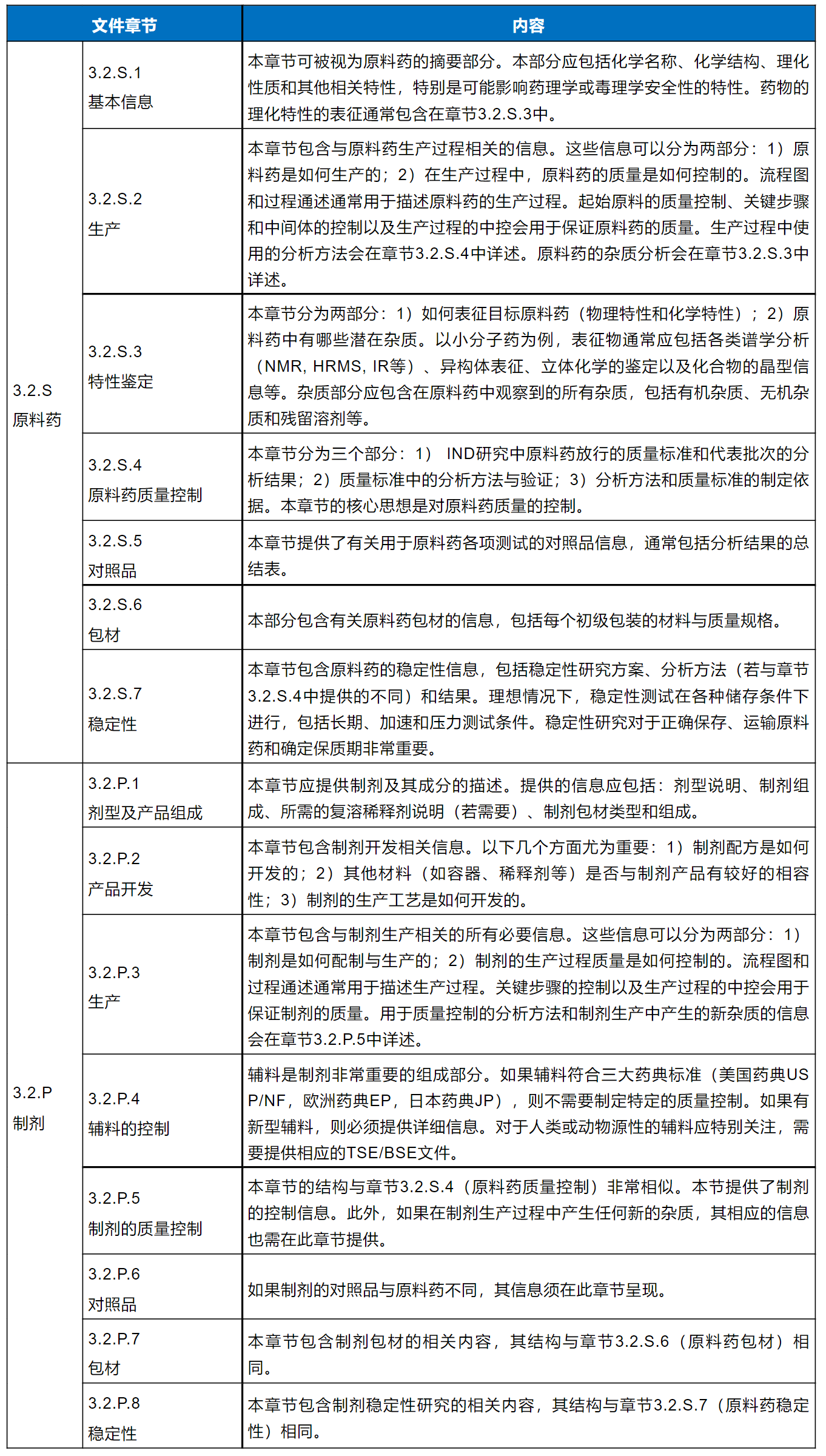
目前,用于药物申请(IND、NDA/BLA等)的申报资料会以通用技术文件格式(CTD)提交给FDA。CMC的内容主要在模块3(Module 3)——药物质量中。模块3分为4个部分,包括原料药(3.2.S)和制剂(3.2.P)2个主要部分及其附录(3.2.A)和区域性信息 (3.2.R)。下表概述了美国IND申请时模块3中原料药和制剂中所包含的内容要点。
中美双报_FDA IND/NDA/BLA_新药注册-奥来恩医药
02.奥来恩如何帮助您解决IND申请中CMC部分遇到的问题?
CMC部分会为您的美国IND申请带来困扰吗?我们希望您在阅读这两篇《奥来恩专家解读》文章后对CMC要求已经有了更清楚的了解。尽管CMC部分包含很多复杂的技术信息,并且药政指南详细且繁琐,但我们经验丰富且敬业的团队将帮助您克服重重困难。作为领先的全球药政法规事务咨询公司,奥来恩帮助众多客户准备了大量的美国、中国、欧洲等地区的IND 申请,有着100%申报成功率。并且在NDA/BLA的申请以及孤儿药、快速通道、突破性治疗等特殊申请方面也拥有丰富的经验。奥来恩的CMC团队实力雄厚,团队成员均具有深厚的化学、生物背景,以及在工业界的从业经验或FDA、NMPA审评经验。我们的专业团队从项目启动开始支持您,进行差距分析、IND会议CMC文件准备、IND模块3资料的准备、修订与提交,一直到您的药物最终获得FDA的NDA/BLA批准。由于CMC文件被誉为“活着的文件”,需要不断更新。奥来恩出色的文件维护和记录服务将支持您顺利走过药物申报批准中的每一步。
信息来源:
[1]. ICH M4Q(R1) CTD on Quality. September 2002.
[2]. ICH Q1A(R2) Stability Testing of New Drug Substances and Products. August 2003.
[3]. ICH Q3A(R2) Impurities in New Drug Substances. October 2006.
[4]. ICH Q3B(R) Impurities in New Drug Products. June 2006.
[5]. ICH Q3C(R8) Impurities: Guideline for Residual Solvents. May 20, 2021.
[6]. ICH Q11 Development and Manufacture of Drug Substances. November 2012.


