第45期 / 本文由奥来恩团队原创
本期看点:ODAC会议启示研讨会;首个国产重组新冠病毒蛋白疫苗获NMPA附条件批准;FDA发布三篇肿瘤临床试验指南终稿;传奇生物CARVYKTI™获FDA批准;艾伯维乌帕替尼缓释片获NMPA批准;国药集团中国生物脊髓灰质炎灭活疫苗通过世界卫生组织预认证;多款药物获药监部门特殊审评认定。
中美双报_FDA IND/NDA/BLA_新药注册-奥来恩医药
近期会议
• SAPA,2022.03.06,10-11am,LessonsLearned from the FDA ODAC Meeting with Innovent/Lilly,FDA的这堂公开课到底讲了什么?- 信达/礼来ODAC会议的启示
https://us02web.zoom.us/webinar/register/WN_VbqiUVJcRDKZ5SON_B-9WQ
• FDA,2022.03.10,Cellular, Tissue, and Gene Therapies Advisory CommitteeMarch 10, 2022 Meeting Announcement
https://www.fda.gov/advisory-committees/advisory-committee-calendar/cellular-tissue-and-gene-therapies-advisory-committee-march-10-2022-meeting-announcement-03102022
• FDA,2022.03.10,Conversations on Cancer: “More Isn’t Always Better:Understanding Cancer Treatment Tolerability”
https://www.fda.gov/news-events/fda-meetings-conferences-and-workshops/conversations-cancer-more-isnt-always-better-understanding-cancer-treatment-tolerability-03102022
COVID-19
【NMPA】首个国产重组新冠病毒蛋白疫苗!已获NMPA附条件批准
3月1日,NMPA附条件批准安徽智飞龙科马生物制药有限公司重组新型冠状病毒蛋白疫苗(CHO细胞)的上市注册申请。该疫苗是首个获批的国产重组新冠病毒蛋白疫苗,适用于预防新型冠状病毒感染所致的疾病(COVID-19)。
来源:NMPA官网
点击查看:
https://www.nmpa.gov.cn/yaowen/ypjgyw/20220302143909157.html
法规政策
【FDA】FDA发布3篇肿瘤临床试验指南终稿
3月1日,FDA向业界发布了3篇关于肿瘤临床试验的指南终稿:
1. 《在肿瘤临床试验中纳入更年长的病人》(Inclusion of Older Adults in Cancer Clinical Trials),该指南就在抗肿瘤药物临床试验中纳入更年长的病人(65岁及以上)向申请人和机构审查委员会提出建议;
2. 《扩展分组:用于首次人体临床试验以加快抗肿瘤药物和生物制品的开发》(Expansion Cohorts: Use in First-in-Human ClinicalTrials to Expedite Development of Oncology Drugs and Biologics),该指南就如何设计和开展具有多个扩展队列的试验提供建议,从而允许同时将患者纳入不同的分组以评估首次用于人体的抗肿瘤药物的安全性、药代动力学和抗肿瘤活性;
3. 《主方案:高效的临床试验设计策略以加快抗肿瘤药物和生物制品的开发》(Master Protocols: Efficient Clinical Trial DesignStrategies to Expedite Development of Oncology Drugs and Biologics),该指南描述了关于主方案设计所需的信息,包括申请人应该向FDA递交哪些内容作为试验设计策略的一部分,同时还指导申请人如何与FDA互动以促进高效的审评并降低给患者带来的风险。
来源:FDA官网
新药审批
【FDA】传奇生物CARVYKTI™获FDA批准
2月28日,传奇生物Carvykti™(ciltacabtagene autoleucel;ciltacel)获FDA批准,用于治疗复发性或难治性多发性骨髓瘤(r/r MM)成年患者,这些患者先前接受过四种或更多治疗,包括一种蛋白酶体抑制剂、一种免疫调节药物和一种抗CD38单克隆抗体。Carvykti™是一种靶向BCMA(全人源自体B细胞成熟抗原)的CAR-T(嵌合抗原受体自体T细胞)疗法。

来源:传奇生物官网
【NMPA】艾伯维乌帕替尼缓释片获NMPA批准
近日,艾伯维宣布,NMPA已批准瑞福®(乌帕替尼缓释片),适用于对其他系统治疗(如激素或生物制剂)应答不佳或不适宜上述治疗的成人和12岁及以上青少年的难治性、中重度特应性皮炎患者。
瑞福®(乌帕替尼缓释片)是国内首个获批用于治疗特应性皮炎的口服选择性JAK(Janus激酶)抑制剂。
来源:艾伯维官网
点击查看:
https://www.abbvie.com.cn/pressroom/2019-news-archive11/_-_1111.html
【NMPA】国药集团中国生物脊髓灰质炎灭活疫苗通过世界卫生组织预认证
近日,世界卫生组织表示,国药集团中国北京生物制品研究所的Sabin株(Vero细胞)脊髓灰质炎灭活疫苗(sIPV)通过预认证,可供联合国系统采购。
此次国药中生脊髓灰质炎灭活疫苗通过世界卫生组织预认证,成为第七个通过预认证的中国国产疫苗,标志着中国疫苗产品的监管、研制和生产体系及产品质量获得了国际的认可,也将为全球消灭骨髓灰质炎疾病作出重大贡献。
来源:NMPA官网
点击查看:
https://www.nmpa.gov.cn/yaowen/ypjgyw/20220301102857113.html
特殊审评
【FDA】Harpoon Therapeutics的HPN217获FDA快速通道认定
3月2日,Harpoon Therapeutics, Inc.的HPN217获FDA快速通道认定(FTD),用于治疗复发性、难治性多发性骨髓瘤(RRMM)患者,这些患者此前至少接受过四种治疗。
来源:Harpoon Therapeutics官网
【NMPA】泰诺麦博生物TNM002注射液纳入拟突破性治疗品种
近日,珠海泰诺麦博生物技术有限公司TNM002注射液纳入拟突破性治疗品种,拟用于预防破伤风。
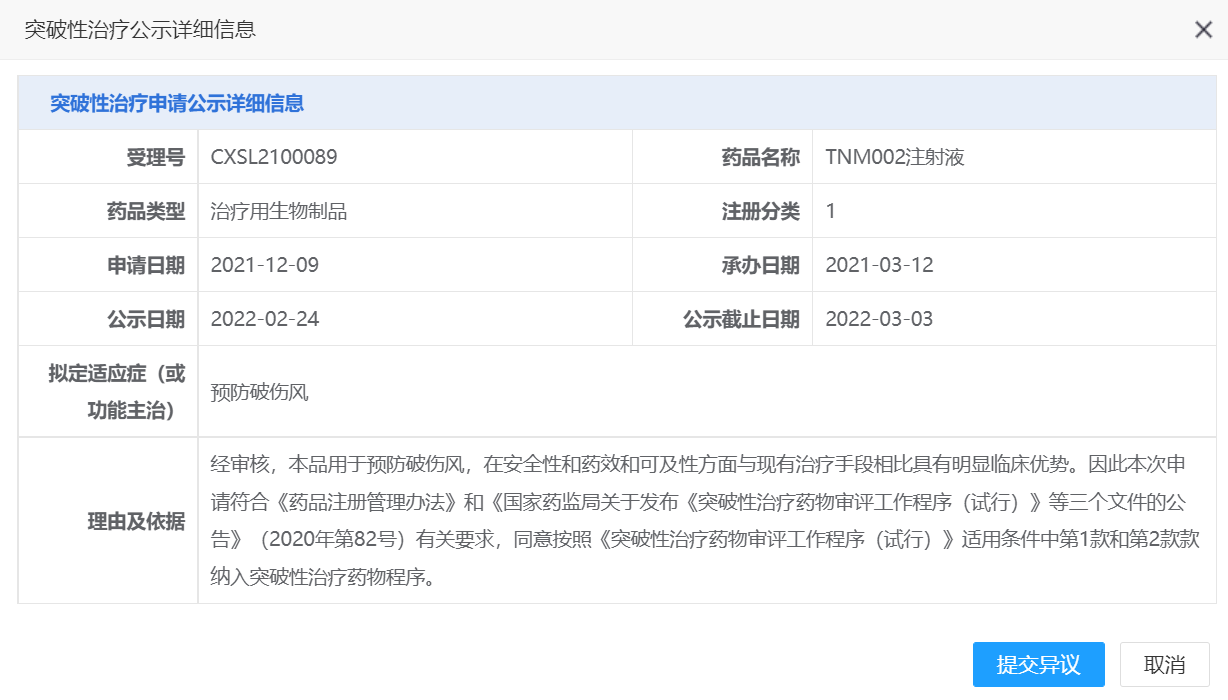
来源:CDE官网
点击查看:
https://www.cde.org.cn/main/xxgk/listpage/da6efd086c099b7fc949121166f0130c
【NMPA】2款药物纳入拟优先审评品种
近日,勃林格殷格翰(中国)投资有限公司2款药物纳入拟优先审评品种:司柏索利单抗注射液,拟用于治疗成人泛发性脓疱型银屑病发作;恩格列净片,拟用于降低心力衰竭成人患者的心血管死亡和因心力衰竭住院的风险。
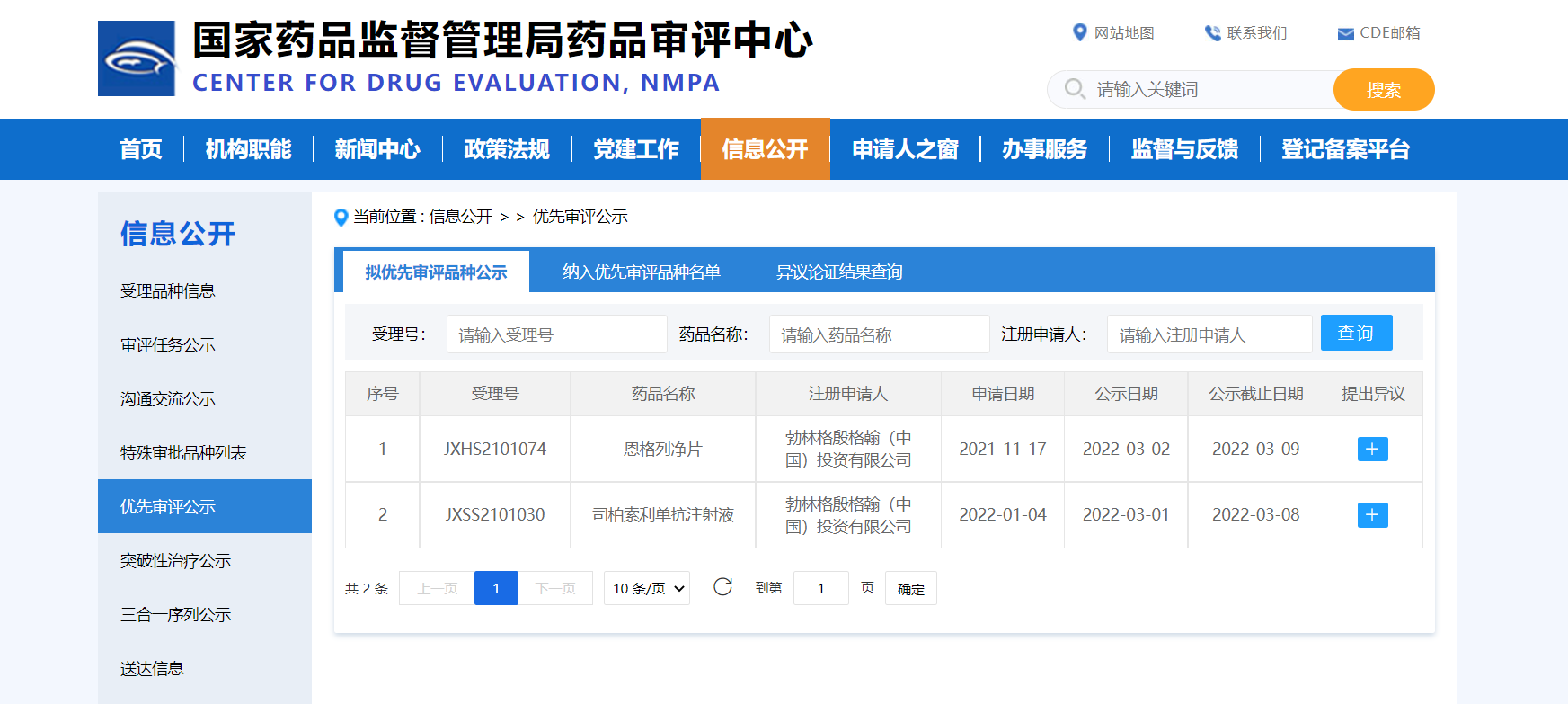
来源:CDE官网
点击查看:
https://www.cde.org.cn/main/xxgk/listpage/2f78f372d351c6851af7431c7710a731


