第50期 / 本文由奥来恩药政策略与临床方案卓越委员会(CPEC)团队原创
加速批准(Accelerated Approval)是FDA在1992年设立的、用以促进治疗严重或危及生命疾病的药物开发的加快通道,允许在研药物基于合理预测临床获益(Clinical Benefit)的替代终点或者中期临床终点(Intermediate Clinical Endpoint)的数据来支持药物获得上市批准。
中美双报_FDA IND/NDA/BLA_新药注册-奥来恩医药
但是,加速批准要求新药研发公司(或申请人)在药物获批上市后,必须继续进行确证性临床试验(Confirmatory Trial),以验证该药物确实能提供临床获益,从而最终获得常规批准(Regular Approval)或完全批准(Full Approval)。反之,如果上市药物不能证实临床获益,FDA可能会启动监管程序撤销该药物的加速批准。通过加速批准程序,患者可以尽早获得新的药物治疗手段,新药研发企业可以在销售新药的同时收集关于临床获益的确证性证据,极大缩短了新药上市的时间(详见《奥来恩专家解读》第7期)。
近年来,加速批准替代终点与临床获益之间的关系、完成确证性临床试验所需的时间、以及确证性临床试验未能显示出临床获益而撤回批准适应症等问题受到广泛关注。FDA肿瘤卓越中心(OCE)主任Richard Pazdur博士等FDA专家在2022年10月22日《新英格兰医学杂志》发表的题为《The On- andOff-Ramps of Oncology Accelerated Approval》的文章中[1],强调了加速批准计划的改革需要综合性策略(ComprehensiveStrategy),并指出“对加速批准计划的改革不应该只专注于授予加速批准之后的流程,也需在授予加速批准之前,就支持加速批准和确证性临床获益的临床试验设计、临床终点、研究的患者人群以及时间线等因素进行综合性考量”。
01.加速批准的现状与面临的挑战
虽然加速批准最初用于抗艾滋病(AIDS)药物,但是在过去10年中,大约85%获得加速批准的药物均用于抗肿瘤治疗领域,覆盖超过了172个肿瘤适应症。在这些获得加速批准的肿瘤适应症中,50%药物(86个适应症)的临床获益得到后续临床数据的确证,仅12%药物(21个适应症)的加速批准被撤回。
根据一项针对1992-2021年FDA药物评价与研究中心(CDER)加速批准的278种药物(适应症)的统计分析显示[2],在过去30年加速批准的新药数量总体呈现增加趋势。尤其是最近5年,获得加速批准的药物明显增加,仅在2020-2021年期间获批新药的占比高达25%(70/278)。而在这278种加速批准的药物中,有104种新药尚未完成确证性临床试验,占比高达37%(详见下图1)。在这些未完成确证性临床试验的104种新药中,约34%(35/104)新药至少有一项确证性临床试验超过了计划完成日期(与FDA达成协议的完成日期),平均逾期约20个月(1.5年)。
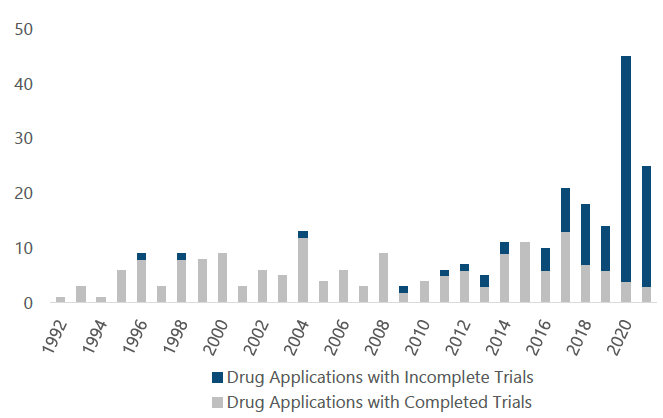
图1.1992-2021年FDA CDER新药获得加速批准与确证性临床试验完成情况
(来源:OIG analysis of FDAaccelerated approval data,2022)
此外,自1992年起截至2022年5月,35种新药适应症(占比约13%)的加速批准已被撤回;仅2021年1月至2022年5月,就有18种获批新药适应症被撤回。其中,FDA在2021年4月与2022年4月召开的、针对未达到预期临床获益的确证性临床试验(临床试验结果为阴性)进行讨论的两次专家委员会(Oncologic Drugs Advisory Committee,ODAC),最终导致已上市获批的11个新药适应症被撤回,包括了加速批准Pembrolizumab(Keytruda®)治疗胃食管交界处(GEJ)腺癌和Nivolumab(Opdivo®)治疗肝细胞癌(HCC)这两个适应症。具体内容详见《奥来恩专家解读》第10期。
据统计,从新药的临床获益得到验证至加速批准转换为完全批准的时间为3.0年(中位数),因临床获益未得到验证而撤回适应症所需的时间为3.8年(中位数)。由此可见,对于那些在获得加速批准时就已经启动确证性临床试验的药物,无论是因为临床获益得到验证并将加速批准转化为完全批准,还是由于临床获益未获得验证而导致撤回适应症,所需时间都相对较短(中位数分别为3.0年和3.8年)。但是,如果获得加速批准时确证性临床试验尚未启动,转化为完全批准的时间则延长至5.1年(中位数),而因未获得临床获益验证而撤回适应症的时间也长达7.3年(中位数)。详见下图2。FDA专家指出,药物研发公司是否在获得加速批准时就已经启动确证性临床试验,是决定所需时间长短的关键因素之一。最近3年,大约38%新药申请在授予加速批准时就已经开展了临床确证性试验。因此,在加速批准授予之前已经启动临床确证性试验或完成受试者入组,将成为FDA对加速批准监管要求的新趋势。
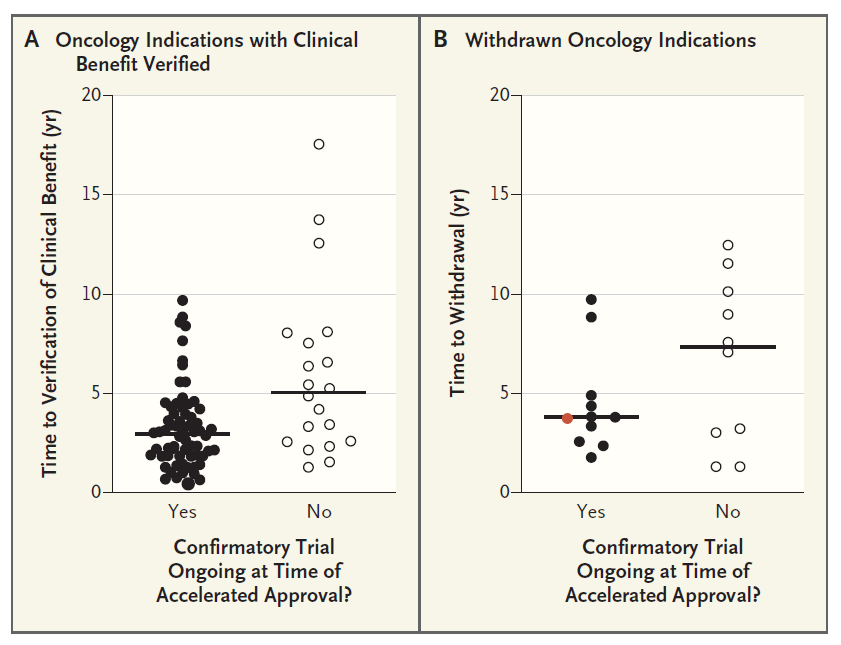
图2.从抗肿瘤药物获得加速批准至完全批准或撤销批准所需要的时间[1]
然而在1992-2021年CDER加速批准的新药中,有4种新药的确证性临床试验显著延期,晚于计划完成时间64个月(超过5年),甚至长达140个月(近12年),如mafenide acetate(Sulfamylon)。这是由于标准治疗的变化等原因使得申请人难以完成确证性临床试验。目前,FDA正与申请人进行试验设计的相关讨论,以帮助申请人尽早完成该试验。
因此,FDA专家表示,若要改革加速批准程序,除了注重授予加速批准之后的流程,还应强调在获得加速批准之前的临床确证计划。药物研发公司应与FDA提前协商,并制定好确证临床获益的详细计划。
02.如何应对加速批准程序改革的挑战-奥来恩建议
面对加速批准出现的新挑战,新药研发公司在积极申请加速批准的同时,也需要做好充分准备以应对FDA近期可能的改革。FDA对加速批准流程改革的方向之一,很大程度上可能会针对确证性试验的完成予以时限,以确保各公司尽早完成验证。这与欧盟、英国和澳大利亚等国家监管机构的流程相似。因此,制定一个具有前瞻性、全面而详细的加速批准策略与计划,不仅能提供药物充分的有效性证据且确保其安全性,而且能缩短加速批准与确证是否有临床获益所需的时间。下面以抗肿瘤药物的研发为例,结合奥来恩多年的实战经验,提出我们的建议供大家借鉴。
(1)合适的替代临床终点
对于抗肿瘤药物的研发,选择合适的替代临床终点非常重要。常用代替临床终点总体生存期(Overall Survival,OS)的替代临床终点指标包括:总缓解率(Overall Response Rate,ORR)、无进展生存期(Progression-Free Survival,PFS)、无疾病生存期(Disease-Free Survival,DFS)或无事件生存期(Event-Free Survival,EFS)、完全缓解率(Complete Response,CR)等。这些临床试验替代终点都曾经在获得加速批准的抗肿瘤药物中使用过或者已经被FDA认可接受。近年来在FDA加速批准的新药中,在随机或单臂试验设计中以ORR或CR作为替代终点已经成为最常用的临床指标。此外,新药研发公司需要充分了解替代终点与临床终点之间可能出现的差异,例如在不同癌症类型和药物类型中表现出的不确定性与不一致性。如果新药研发公司希望在临床试验中使用一种尚未被FDA认可或新的替代终点,建议新药公司提交Type C会议申请,与FDA进行正式交流以确定是否可行。
(2)科学的临床试验设计与合理的研究策略
对于临床试验设计的考量也是一个重要因素,FDA专家建议新药研发公司在开始加速批准计划之前,可以开展充分的剂量优化与活性探索(Activity-Finding)研究。通常新药研发公司会先开展一项单臂(Single-Group)试验,用于支持加速批准;随后启动一项随机对照试验以确证临床获益。FDA建议新药公司可以考虑直接启动一项单臂随机试验(Single RandomizedTrial)用于同时支持加速批准和验证是否临床获益。加速批准可以基于预先计划的、对总缓解率(ORR)进行的期中分析 (Interim Analysis),完全批准则可以基于在临床试验完全结束后表现出的临床获益,通常为总体生存期(OS)。这一策略能够提供更全面的安全性评估,并为获益-风险(Benefit-Risk)评估提供早期较明确的证据。它同时也减少了过早终止那些ORR改善有限却能够延长OS的项目的风险。
此外,研发公司也可以根据药物开发计划与在研药物自身特点,考虑同时进行两项研究的替代策略(AlternativeStrategy):即一项单臂试验用于支持基于ORR的加速批准,招募没有其他可用治疗选择的患者;另一项随机试验作为验证临床获益的确证性研究,招募接受前期治疗较少的患者。对这些试验进行的安全性与ORR的期中分析,能够提供更多支持性证据,并提高授予加速批准的信心。
03.奥来恩如何帮助您制定加速批准策略并成功获得FDA批准?
奥来恩作为领先的全球药政法规咨询与注册团队,凭借累积多年的FDA、NMPA、EMA等主要国际市场的药政法规与注册经验,包括多个准备与申请FDA加速通道及孤儿药认定的成功经验,为您提供差距分析、申请策略规划、资料准备以及与FDA的有效沟通交流,助力加快您的新药研发并早日成功获批,造福患者。欢迎联系我们咨询如何加速您的新药研发项目。

▲ 长按扫码,分享朋友圈
信息来源:
[1]. Lola A. Fashoyin-Aje, Gautam U. Mehta, Julia A, Beaver, and Richard Pazdur. The On- and Off-Ramps of Oncology Accelerated Approval. N Engl J Med 2022; 387: 1439-1422. October 20, 2022.
[2]. Delays in Confirmatory Trials for Drug Applications Granted FDA’s Accelerated Approval Raise Concerns. Office of Inspector General Data Snapshot. September 29, 2022.
[3].《奥来恩专家解读》第7期:FDA加速批准-新药研发与审评的加速通道系列之四。
[4].《奥来恩专家解读》第10期:药物获得FDA加速批准或的可能结果-新药研发与审评的加速通道系列之六。


