第11期 / 本文由奥来恩团队原创
奥来恩编者按:
中美双报_FDA IND/NDA/BLA_新药注册-奥来恩医药
2023年1月10日,FDA药物评价与研究中心(CDER)发布了2022年新药批准总结报告。2022年共有37种新药上市,新药获批数量明显减少,较2021年获批的50种新药降低了26%,甚至低于过去10年(2013年-2022年)的新药获批平均数43种(见下图1)。
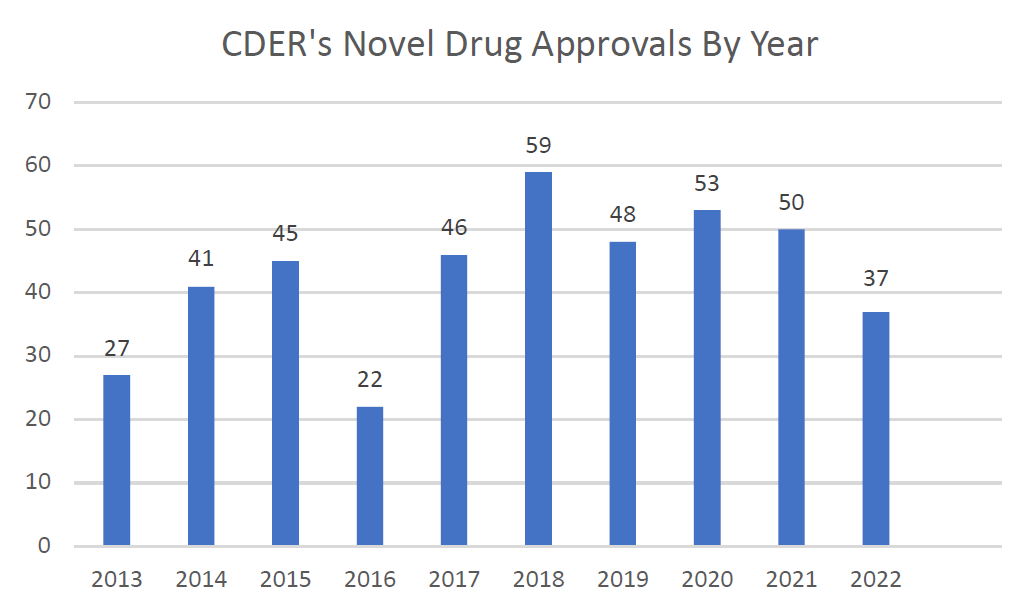
图1. 2013年-2022年FDA CDER批准新药概况
在CDER批准的37种新药中,包括了新分子实体(New Molecular Entities,NMEs)和新的治疗用生物制品(New Therapeutic Biological Products)。其中,20种新药(占比54%)被CDER认定为首创药物(First-in-Class)。此外,25种新药(占68%)通过在美国获得FDA批准后实现了全球首次上市。在获批的37种新药中,共有24种新药(占65%)借助了一种或多种FDA创新药研发与审评的加快通道(Expedited Program)获得批准上市,包括快速通道认定(Fast Track Designation,FTD)、突破性疗法认定(Breakthrough Therapy Designation,BTD)、优先审评(Priority Review,PR)以及加速批准(Accelerated Approval,AA)。
2022年获得孤儿药认定(Orphan Drug Designation,ODD)的新药依然保持相对较高的比例,为54%(20种),较2021年增加2%。然而,与2021年相比,借助FDA创新药研发与审评加快通道获批上市的新药比例减少6%(68%比74%)。值得关注的是,2022年获批新药中有35%(13种)获得了FDA突破性疗法认定,较2021年相比上升了7%。但是其他FDA加快通道认定的数量与比例,较2021年相比,都有所降低。其中仅16%(6种)新药获得了FDA加速批准(AA),对比2021年下降了12%;57%(21种)新药获得优先审评认定(PR),较2021年下降了11%;32%(12种)新药获得了快速通道认定(FTD),较2021年下降了4%。2021年CDER新药批准情况分析详见《奥来恩专家解读》第27期。另一个值得关注的是,生物类似药(Biosimilar)和可互换性生物类似药(Interchangeable Biosimilar)的批准。自2015年起至今,CDER共批准了40种生物类似药,对应11种不同的参照药。而仅2022年,CDER就批准了7种新的生物类似药,其中2种是可互换性生物类似药,即患者可以在没有医生处方介入的情况下,将这两种生物类似药作为参照药的替代产品使用。尽管2022年FDA CDER新药获批数量减少,但是CDER收到的新药申请数量与过去几年相似,甚至高于历史申报数据,这表明创新药研发并未因疫情停滞,始终保持强大的活力。特别是,多种获批新药针对罕见病(Rare Disease)的治疗,包括转移性或不可切除的葡萄膜黑色素瘤、肌萎缩性侧索硬化症(ALS)、广泛性脓疱性银屑病等,将有助于解决未满足的临床需求,改善患者的生活质量。让我们期待2023年更多的创新药物获批!
点击查看:
[1]. FDA website. FDA Approved Many New Drugs in 2022 That Will Improve the Lives of Patients and Consumers. January 2023.
[2].《奥来恩专家解读》第27期:2021年FDA CDER批准新药的分析-创新药获得FDA批准的加快通道。2022年01月10日。


