本文由奥来恩团队原创
本期看点:CDE发布《eCTD实施指南V1.1(征求意见稿)》及《eCTD验证标准V1.1(征求意见稿)》;CDE发布《慢性淋巴细胞白血病新药临床研发技术指导原则》;先诺特韦片/利托那韦片组合包装、氢溴酸氘瑞米德韦片获NMPA附条件批准;第二个国产托珠单抗注射液生物类似药获NMPA批准上市。
中美双报_FDA IND/NDA/BLA_新药注册-奥来恩医药
法规政策
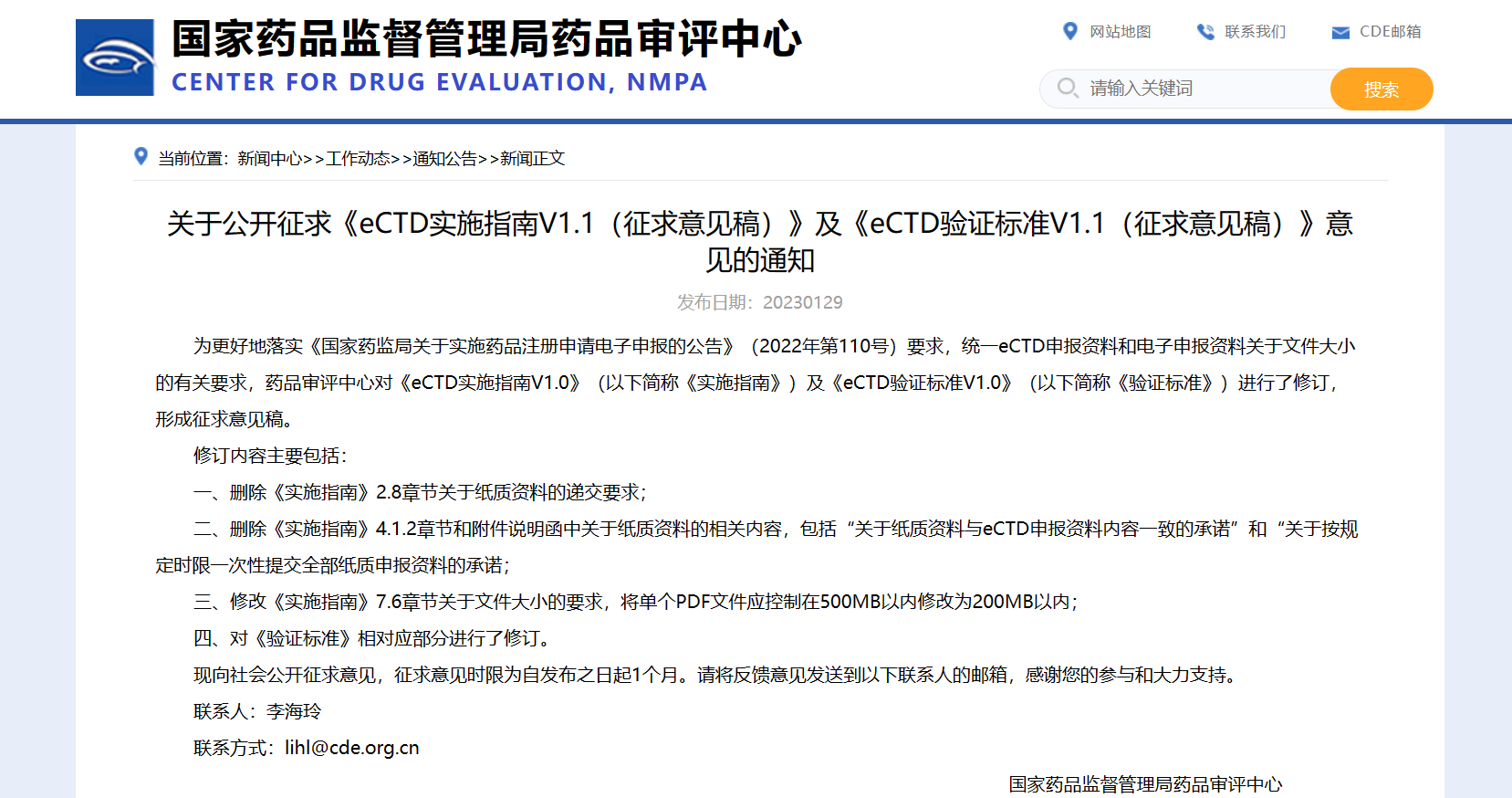
【NMPA】CDE发布《eCTD实施指南V1.1(征求意见稿)》及《eCTD验证标准V1.1(征求意见稿)》
近日,为更好地落实《国家药监局关于实施药品注册申请电子申报的公告》要求,统一eCTD申报资料和电子申报资料关于文件大小的有关要求,CDE对《eCTD实施指南V1.0》(以下简称《实施指南》)及《eCTD验证标准V1.0》(以下简称《验证标准》)进行了修订,形成征求意见稿。
来源:CDE官网
点击查看:
https://www.cde.org.cn/main/news/viewInfoCommon/3c23f1daf2e8c5400836cd5f4ac93cbd
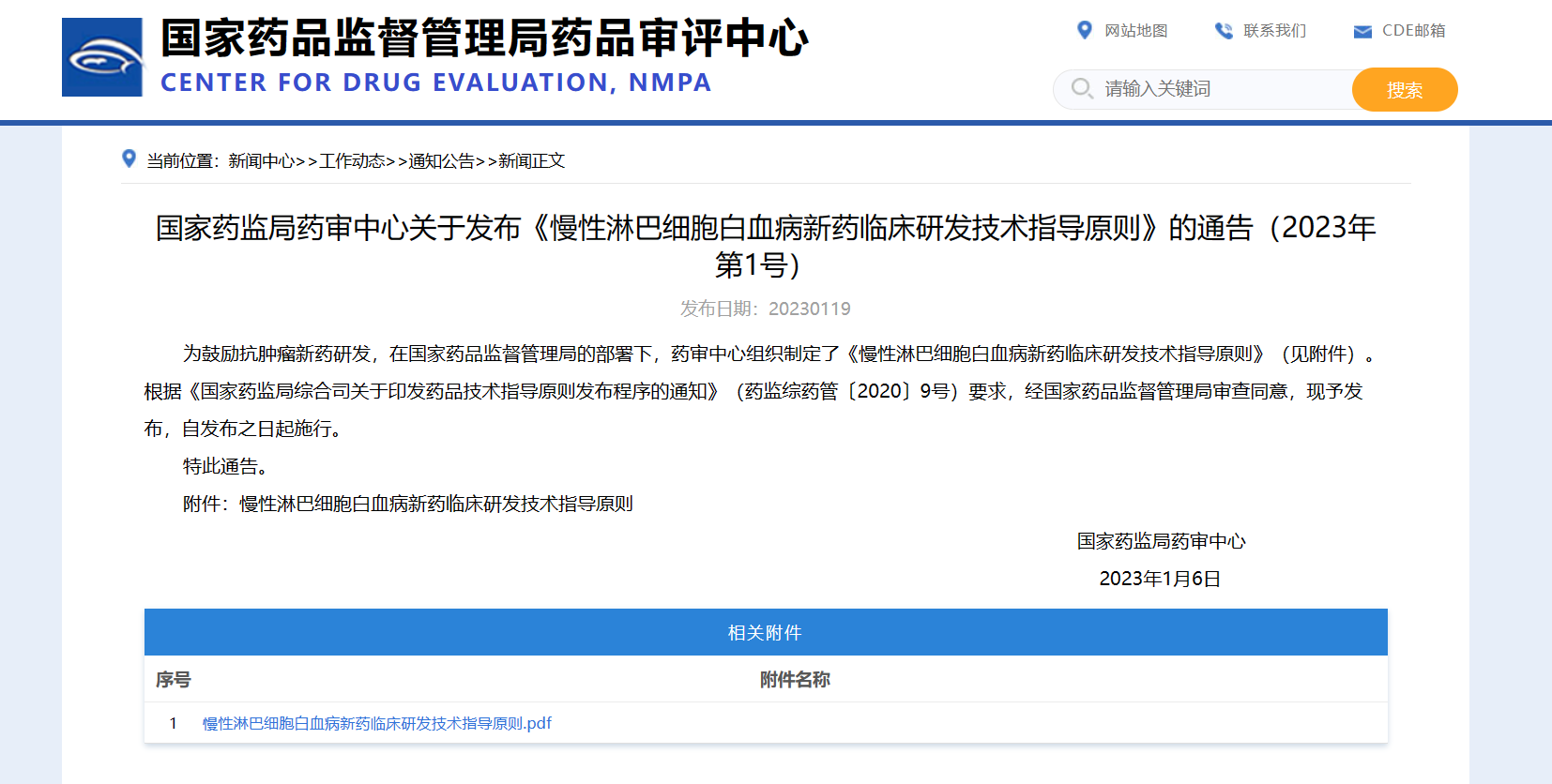
【NMPA】CDE发布《慢性淋巴细胞白血病新药临床研发技术指导原则》
近日,为鼓励抗肿瘤新药研发,在国家药品监督管理局的部署下,药审中心组织制定了《慢性淋巴细胞白血病新药临床研发技术指导原则》。
来源:CDE官网
点击查看:
https://www.cde.org.cn/main/news/viewInfoCommon/8c0155b13a1b704f130960af38c64c9d
新药批准
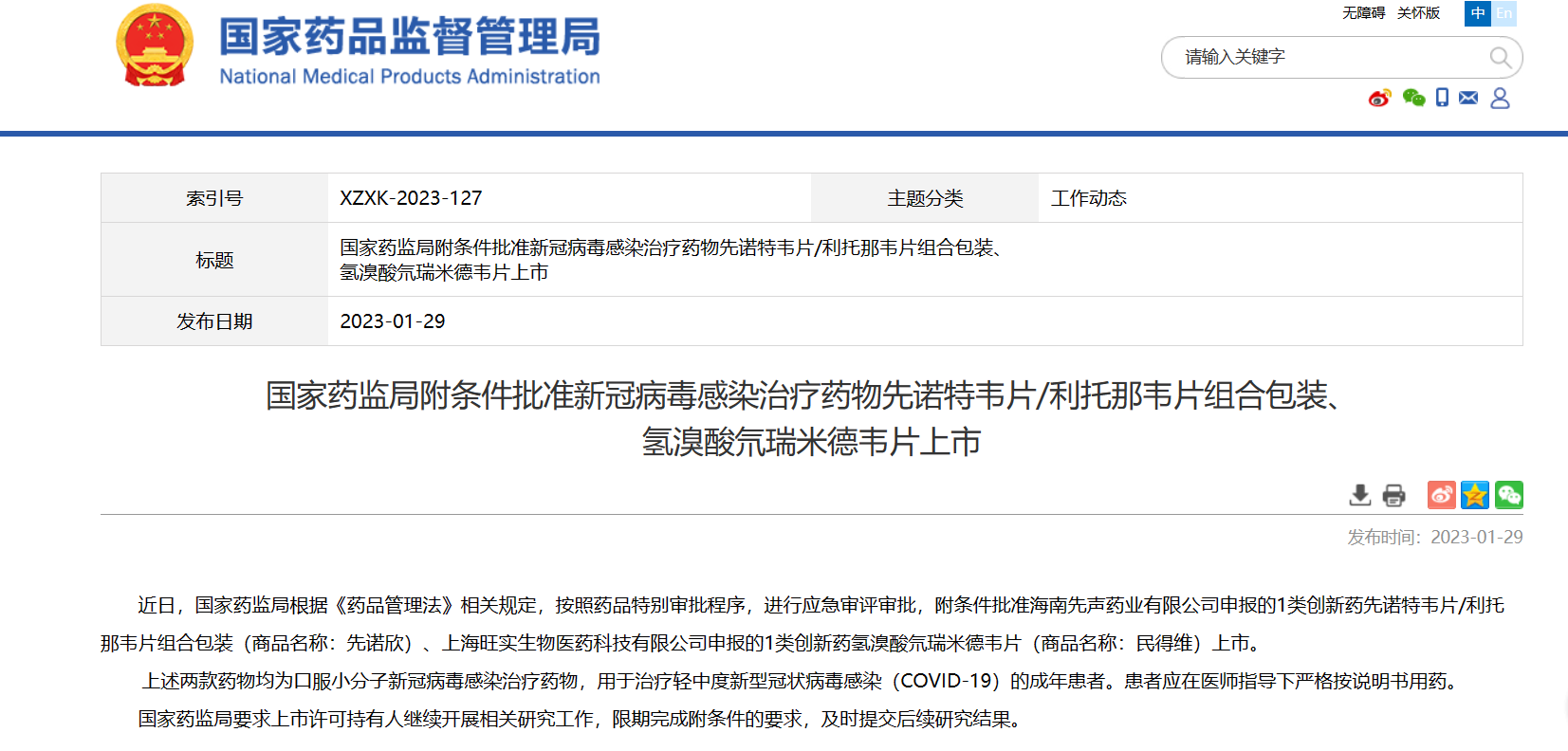
【NMPA】先诺特韦片/利托那韦片组合包装、氢溴酸氘瑞米德韦片获NMPA附条件批准
近日,NMPA按照药品特别审批程序,进行应急审评审批,附条件批准海南先声药业有限公司申报的1类创新药先诺特韦片/利托那韦片组合包装(商品名称:先诺欣)、上海旺实生物医药科技有限公司申报的1类创新药氢溴酸氘瑞米德韦片(商品名称:民得维)上市。两款药物均为口服小分子新冠病毒感染治疗药物,用于治疗轻中度新型冠状病毒感染(COVID-19)的成年患者。
来源:NMPA官网
点击查看:
https://www.nmpa.gov.cn/yaowen/ypjgyw/20230129143814163.html
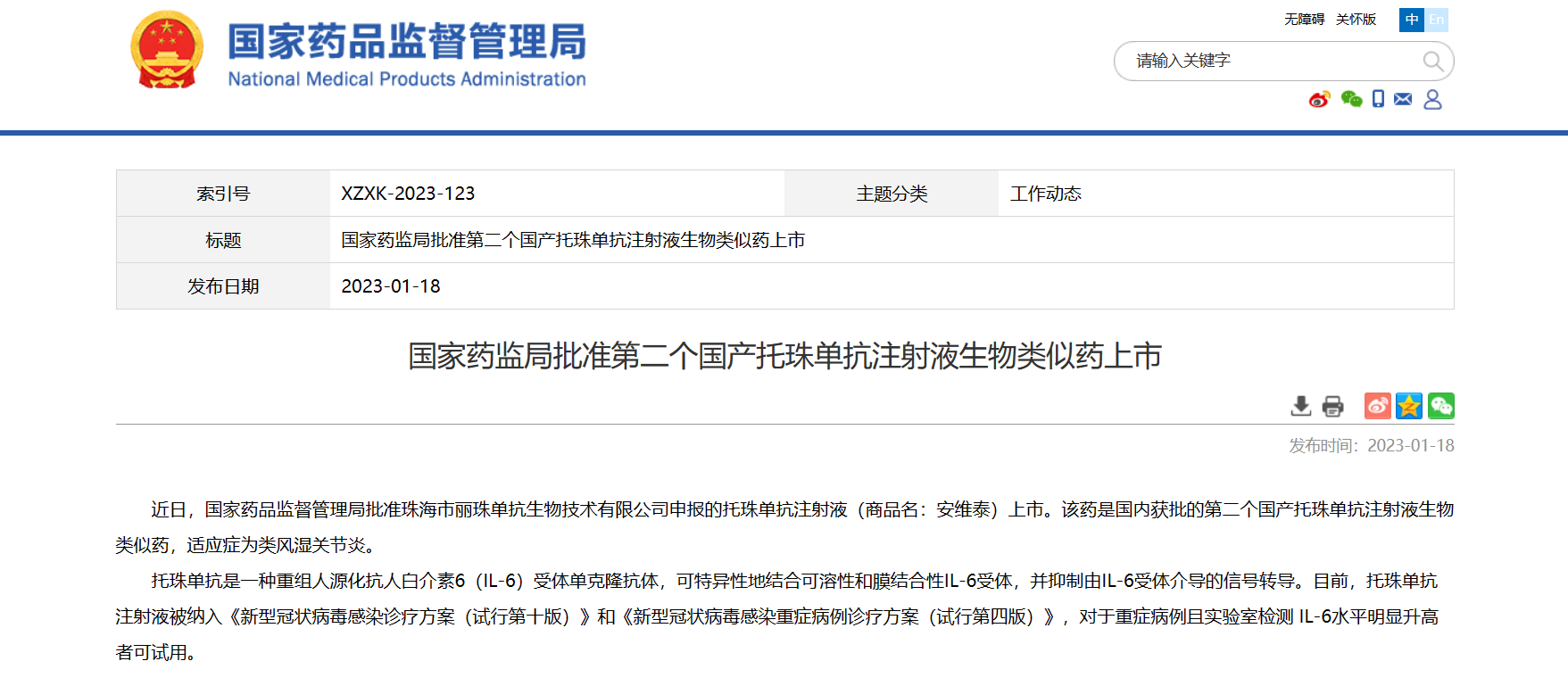
【NMPA】第二个国产托珠单抗注射液生物类似药获NMPA批准上市
近日,NMPA批准珠海市丽珠单抗生物技术有限公司申报的托珠单抗注射液(商品名:安维泰)上市。该药是国内获批的第二个国产托珠单抗注射液生物类似药,适应症为类风湿关节炎。托珠单抗是一种重组人源化抗人白介素6(IL-6)受体单克隆抗体,可特异性地结合可溶性和膜结合性IL-6受体,并抑制由IL-6受体介导的信号转导。
来源:NMPA官网
点击查看:
https://www.nmpa.gov.cn/yaowen/ypjgyw/20230118193614158.html


