第52期 / 本文由奥来恩药政策略与临床方案卓越委员会(CPEC)团队原创
自1983年以来,FDA通过孤儿药认定(Orphan Drug Designation,ODD)计划的一系列优惠政策,如免除NDA/BLA申请费以及减免25%的临床研究费用,激励了诸多新药研发公司致力于治疗罕见的疾病和/或病症的产品开发。
中美双报_FDA IND/NDA/BLA_新药注册-奥来恩医药
今年2月初,FDA发布了主题为“Intersections with rarediseases – A patient focused event”的线上活动[1],确保罕见病患者的声音能够被听到,以支持治疗罕见病的孤儿药研发。
在《奥来恩专家解读》第8期与第41期,我们已经介绍过FDA孤儿药认定和过去10年的认定情况,并着重描述了2022年上半年FDA孤儿药认定的获准情况以及相应罕见病类型。为了支持和鼓励罕见病治疗药物的开发,我们将在本期和后两期的《奥来恩专家解读》陆续对孤儿药系列相关问题进行整理与汇总,希望对新药在研企业有所启发与帮助。
1.罕见病、孤儿药与孤儿药认定
在美国2002年的《罕见病法案》中,对罕见病进行了严格的定义,特指那些“在美国影响不到20万人的任何疾病或病症”,相当于每1600人中约有1人患病。由于罕见病的患病率和发病人数是动态的,所以FDA并没有标准的罕见病目录。
根据1983年美国《孤儿药法案》(Orphan Drug Act, ODA)中的定义,孤儿药是一种用于治疗在美国影响少于20万人疾病的药物。换句话说,孤儿药是用于预防、诊断或治疗罕见病的“特效药物”。而孤儿药认定是FDA孤儿药产品开发办公室(Office of Orphan Products Development,OOPD) 对符合条件的用于预防、治疗或诊断罕见病的药物(包括生物制品)授予的一种资格认定。2022年FDA CDER批准的37种新药中有20种属于孤儿药,比重高达54%。
2.1983年-2022年FDA孤儿药认定的获批趋势
自1983年《孤儿药法案》正式颁布实施以来,药物成功获得FDA ODD的数量逐年递增(见图1)。截至2022年12月,FDA ODD数量共计6352个。1983-2000年,获批的FDA ODD数量相对稳定,平均每年约为59.2个。但2001-2022年,获批的FDA ODD数量逐年递增,从79个增至402个,并在2017年其数量达到峰值477个,约是1984年的12.6倍。由此可见,在FDA的政策激励下,药企对孤儿药的研发热情逐年增加,研发能力也显著提高。
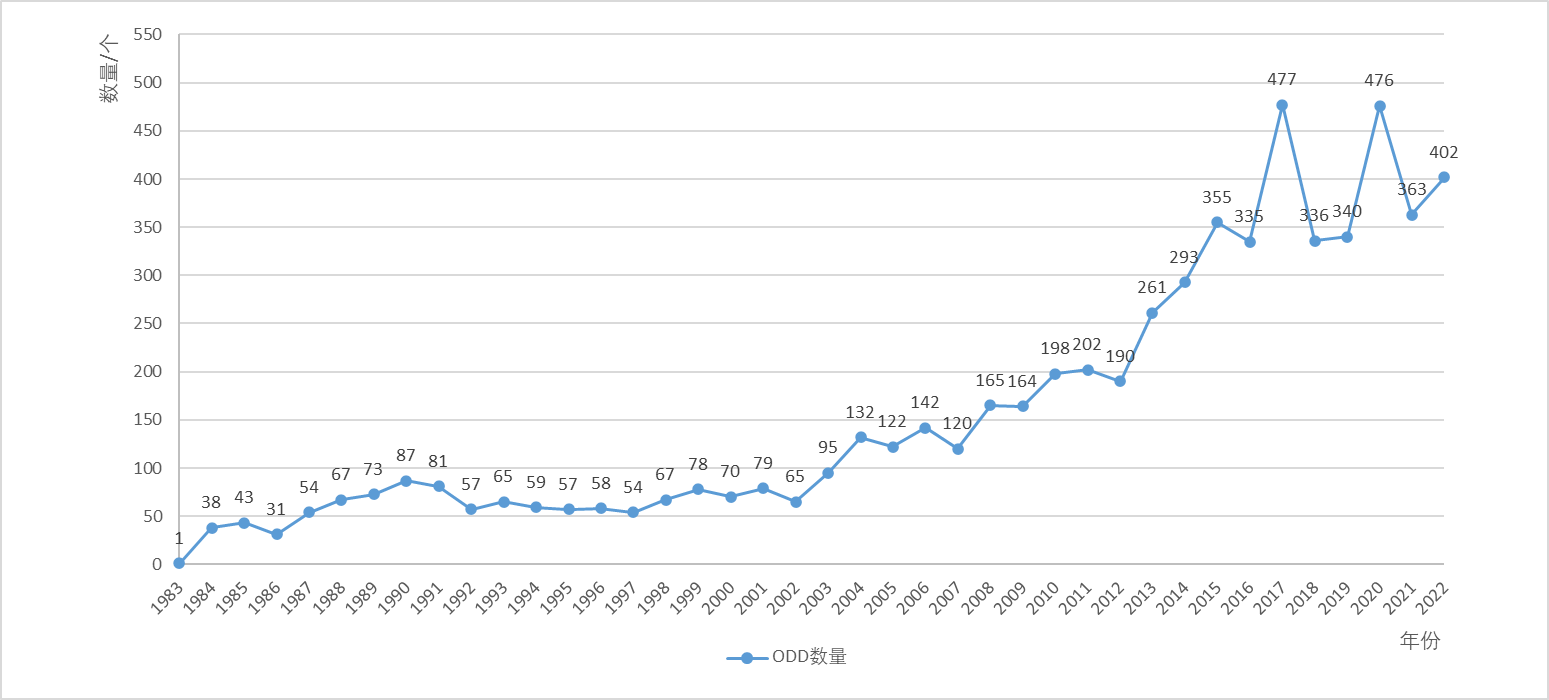
图1.1983-2022年获得FDA孤儿药认定数量
(来源:奥来恩团队汇总制作)
3.申请FDA孤儿药认定需要满足的条件与时间点
除了满足孤儿药的定义以外,以下几种情况也可以申请孤儿药认定:
1)如果一个在研药物(包括生物制品)能在孤儿药认定申请中证明其在治疗、预防或诊断一种罕见病的潜力,OOPD在审评申请资料后将会授予该药物ODD。一般情况下,临床研究数据、动物模型(In-Vivo)数据以及体外研究(In-Vitro)结果均有可能作为证明在研新药有效性潜力的科学依据。
2)药物的创新性对ODD的授予没有决定性作用。对于一个非创新药物,若其含有的活性物质或主要分子结构特征与既往已批准药物相同,并且拟定治疗罕见病(或适应证)也相同,但是如果该新药显示出优于已上市药物的临床优势,同样也可以获得孤儿药认定。
3)对于患病人数大于20万的非罕见疾病,如果在研药物适用于该非罕见病的罕见临床亚型(Orphan Subset,所有此亚型患者病人数少于20万),并且通过该药物的属性(例如:作用机制、毒理特征、或已有临床数据)能够证明该药物仅适用于此亚型而不适用于此亚型之外的患病人群,则该药物同样能够获得孤儿药认定。
新药研发公司的在研药物若满足孤儿药认定条件,可以在获得充足的申请ODD的依据后,在上市申请(NDA/BLA)递交之前的任何时间提交ODD申请。但为了尽早享受政策福利,建议新药研发公司在获得动物模型数据后可以考虑提交ODD的申请。通常情况下,OOPD会在收到ODD申请后的90天内予以回复。
4.获得ODD后对项目有何益处?
• 药物获批上市后享有7年市场独占权(Marketing Exclusivity)
• 免除NDA/BLA申请费(PDUFA,目前超过320万美金)
• 临床研究费用享受25%税收减免
• 可能免除或减少部分临床数据的申报要求
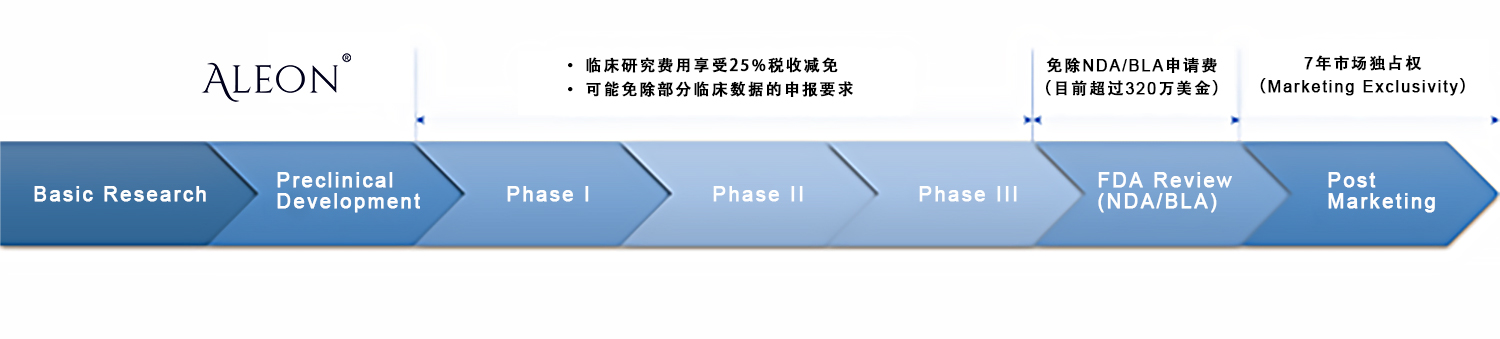
图2.ODD政策福利时间线
(来源:奥来恩团队汇总制作)
5.奥来恩如何帮助您成功获得孤儿药认定?
奥来恩作为专业化的药政法规事务与注册团队,凭借多年的FDA、NMPA以及EMA的药政法规经验,包括多个准备与申请FDA加快通道认定和孤儿药认定的成功经验,为您提供差距分析、申报策略规划、资料准备以及与FDA有效沟通交流等服务,助力加快您的新药研发并早日成功获批,造福患者。
为了支持罕见病治疗药物的开发,即日起至2月28日,奥来恩将为创新药研发公司提供有关孤儿药认定申请的免费咨询与申请准备的最大优惠。机不可失,欢迎您来电咨询(17761872613)。
信息来源:
[1] Public meeting: FDA Rare Disease Day 2023. https://www.fda.gov/news-events/fda-meetings-conferences-and-workshops/public-meeting-fda-rare-disease-day-2023-02272023
[2] 《奥来恩专家解读》第8期:FDA孤儿药认定-新药研发与审评的加速通道系列之五。https://mp.weixin.qq.com/s/4-2B617BzozYr91AnvSG6g
[3] 《奥来恩专家解读》第41期:FDA孤儿药认定趋势和2022年上半年情况深度分析。https://mp.weixin.qq.com/s/WqSohWN6r6u5rw7ClSD18g


