在前两期的奥来恩药政法规「专家解读」系列中,我们向大家介绍了FDA加快新药研发与审评通道之突破性治疗认定和快速通道认定。本期我们将向大家介绍FDA关于优先审评认定的相关法规与申请程序。
优先审评认定 (Priority Review Designation) 作为加快药物研发与审评通道之一,是FDA通过缩短审评时间以达到加快用于治疗严重疾病的创新药研发与获批目的的一种举措。与标准的审评时间(10个月)相比, FDA对获得优先审评认定的药物,会在6个月内完成上市审批。该资格认定于1992年开始实施,随后修订成为2012年《食品与药品管理局安全与创新法案》(Food and Drug Administration Safety and Innovation Act,FDASIA)的一部分。根据对2018-2020年FDA药物评价与研究中心(CDER)批准的创新药分析,获得优先审评认定的新药所占的比例分别为73%(2018年)、58%(2019年) 和57%(2020年),超过了获批新药的一半。

申请优先审评认定需要满足哪些条件?
对于一种在研药物,如果用于防治严重疾病、并且有证据显示该药物有明显优于现有治疗手段的临床价值,例如能够显著改善药物的有效性或安全性,则新药研发公司可以在递交新药上市申请(NDA/BLA)或有效性补充申请(efficacy supplement)时,向FDA申请优先审评认定。这些证据包括:能明显提高诊断、治疗或预防疾病的效果,或者消除或明显减少限制药物使用的不良反应,或者能够提高患者的依从性进而改善疾病的严重结果,以及有证据显示该药物在新的人口亚群中的安全性与有效性。
何时提交优先审评认定申请?
新药研发公司可以在递交NDA/BLA时提交优先审评认定申请。通常,FDA不建议在BLA/NDA (或有效性补充申请)递交后提交该申请。对于使用优先审评券(详见后续介绍)的新药上市申请(NDA/BLA), FDA会自动将其列入优先审评品种。对于曾获得快速通道认定(FTD)或突破性治疗认定(BTD)的创新药或者申请加速批准的药物,FDA则会根据递交NDA/BLA的信息和数据决定是否授予优先审评认定。
FDA对优先审评申请的审评时限是多久?
对于提交的优先审评认定申请,FDA将在收到NDA/BLA (或有效性补充申请)的60天内予以回复。
什么是优先审评券?
优先审评券(Priority Review Vouchers,PRVs)是美国FDA最初为了激励热带疾病新药(包括生物制品)的研发,于2007年建立的一种优先审评券制度。在热带疾病优先审评券(Tropical Disease Priority Review Vouches)计划中,列出了适用于PRV的热带疾病,并规定了相应的认定标准。FDA依据审评结果,对符合条件的、用于治疗或预防热带疾病药物的研发公司授予优先审评券。目前热带疾病目录主要包括了27 种热带疾病,详见表1。
表1.申请热带疾病优先审评券的热带疾病目录
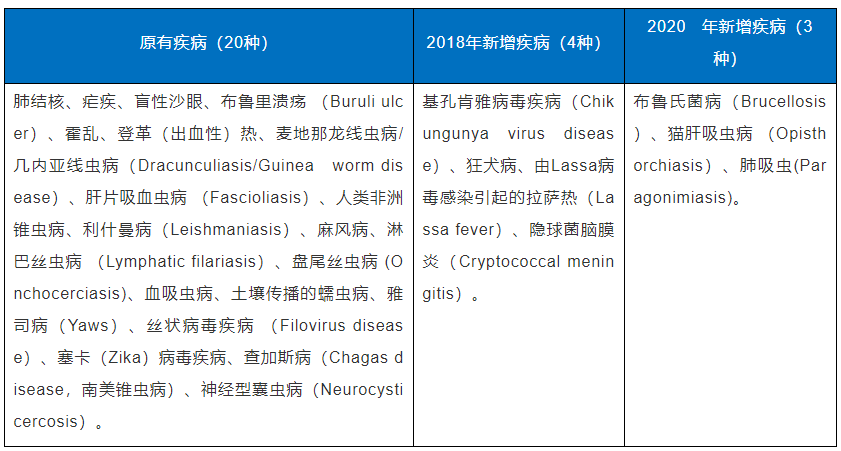
除了热带疾病优先审评券,罕见儿科疾病优先审评卷(Rare Pediatric Diseas Priority Review Vouches)也是FDA授予创新药的另外一种优先审评券。
罕见儿科疾病优先审评券主要是为了鼓励罕见儿科疾病产品的研发而制定的一种制度。该计划成为2012年《食品与药品管理局安全与创新法案》(FDASIA)一部分。如果一种药物用于预防或治疗罕见儿科疾病、且其含有的活性成分在其他已批准药物中从未出现(或存在)过,并且符合优先审评的资格认定,则新药研发公司可以获得罕见儿科疾病优先审评券。虽然FDA曾几次告知将终止罕见儿科疾病优先审评券计划,但是在2020年12月27日,该优先审评券计划又被延长至2026年9月30日。
优先审评券对项目研发有何益处?
获得优先审评券的药物研发公司,可以将其优先审评券兑现用于将来其他药物申请的优先审评。此外,优先审评券也可以转让或出售给其他药物研发公司。优先审评券的最终持有人在递交其新药申请时,可以使用优先审评券直接获得优先审评的资格。对于不符合优先审评条件的药物,若使用优先审评券,将会极大缩短该药物的审评时间,从而实现其早日上市。在2020 年FDA CDER批准的创新药中,用于治疗儿童和成人严重疟疾的创新药artesunate,曾获得FDA快速通道认定(FTD)、突破性治疗认定(BTD)、优先审评认定以及孤儿药认定(ODD)。该研发公司Amivas, LLC (Amivas) 在新药artesunate获批的同时,也获得了1张热带疾病优先审评券,可以用作未来其他药物上市申请时的优先审评。当然,也可以出售给其他公司。
根据对2009-2019年数据分析, FDA共授予了31张优先审评券。在这些被授予的优先审评券中,有17张随后被出售给其他新药研发公司,售价在0.675亿美元至3.5亿美元之间。而在已经兑现使用的16张优先审评券中,有12 张是新药研发公司通过购买其他公司拥有的优先审评券而获得的。因此,通过获得优先审评券来加速新药研发与审评,也成为新药研发公司制定研发战略的重要考量因素之一。
获得优先审评认定后对在研项目有何影响?
在研药物被授予优先审评认定后,FDA会根据内部相应的审评程序与政策,调动资源保证优先审评,确保在6个月内完成上市审批。在激烈竞争的大环境下, 如果新药能够提前4个月获得FDA批准, 对于新药研发公司具有重大意义。新药更早获批也让患者能更早受益。
奥来恩如何帮助您成功获得优先审评认定?
奥来恩作为专业化的新药法规咨询与注册团队,凭借多年的FDA、NMPA及其他主要国际市场的药政法规与注册经验,包括多个准备和申请FDA 加快通道认定和孤儿药认定的成功经验,为您提供差距分析、申请策略规划、资料准备以及与FDA的有效沟通交流,助力加快您的新药研发并早日成功获批,造福病患者。
信息来源:
[1] 奥来恩专家解读:FDA加快创新药研发与审评的通道-2020年CDER批准的新药分析. 2021-02-05.https://mp.weixin.qq.com/s/uJRZz12QwAmvdWEaz6Oq5g.
[2] FDA Final Guidance for Industry: Expedited Programs for Serious Conditions-Drugs and Biologics. 05/30/2014.
[3] FDA Website: Priority Review. 01/04/2018. https://www.fda.gov/patients/fast-track-breakthrough-therapy-accelerated-approval-priority-review/priority-review.
[4]FDA CDER. Advancing Health Through Innovation: New Drug Therapy Approvals 2018, January 2019. https://www.fda.gov/drugs/new-drugs-fda-cders-new-molecular-entities-and-new-therapeutic-biological-products/novel-drug-approvals-2018.
[5] FDA CDER. Advancing Health Through Innovation: New Drug Therapy Approvals 2019, January 2020. https://www.fda.gov/drugs/new-drugs-fda-cders-new-molecular-entities-and-new-therapeutic-biological-products/novel-drug-approvals-2019.
[6] Section 524 of the FD&C Act.
[7] Section 529 of the FD&C Act.
[8] FDA website: Tropical Disease Priority Review Voucher Program. 07/15/2020. https://www.fda.gov/about-fda/center-drug-evaluation-and-research-cder/tropical-disease-priority-review-voucher-program.
[9] FDA website: Rare Pediatric Disease (RPD) Designation and Voucher Programs. 11/02/2017. https://www.fda.gov/industry/developing-products-rare-diseases-conditions/rare-pediatric-disease-rpd-designation-and-voucher-programs.

