随着中国创新药研发市场的不断壮大,越来越多的新药研发公司为了增强产品和公司竞争力,开始瞄准国际市场,期望通过美国FDA 的审评获得新药在美国的上市批准。在2020年,FDA药物评价与研究中心(CDER)共批准了53个新药 (详见表1 与表2),与2019年相比增加了10%(增加了5个)。在这些获批的新药中,有40个新药(占75%)是通过成功获得FDA批准后在美国实现了全球首次上市;有36个新药(占68%)借助了一种或多种FDA创新药研发与审评的加快通道。因此,借助加快通道、充分利用FDA的政策优势以缩短研发和审评时间,为加快创新药研发实现早日上市提供了捷径。我们结合2020年获得FDA CDER批准的新药,分别简要介绍四种加快通道 (即快速通道认定、突破性治疗认定、优先审评认定和加速批准)和孤儿药认定及其重要性(见表1)。

01、快速通道认定 (Fast Track Designation)
在获批的53个新药中,有17个(占32%)药物在研发早期就获得了FDA快速通道认定。当在研新药用于治疗严重疾病、并且非临床或临床数据显示有解决未满足的医疗需求的潜力时,新药研发公司可以提交快速通道认定申请。一旦申请获得FDA批准,研发公司将会获得更多与FDA沟通交流的机会,充分讨论药物研发计划与研究数据,并且可以在递交上市申请时向FDA滚动递交新药研究资料。02、突破性治疗认定(Breakthrough Therapy Designation, BTD)
在获批的新药中,有22个(占42%)获得了突破性治疗认定 (BTD)。获得BTD的药物是用于治疗严重疾病、并且有初步的临床证据表明该药物与现有的治疗药物相比,在一个或多个具有临床意义的终点上有实质性改善。FDA对于获得BTD的药物有相应的政策和审评程序以提供加速研发和审评的组织保障。研发公司将会与FDA频繁的沟通交流、并获得FDA提供的技术指导,同时也可以向FDA滚动递交新药研究资料。这些政策为加快新药的后续研发提供了保障。03、优先审评认定(Priority Review Designation)
在获批的新药中,有30个(占57%)获得了FDA优先审评认定。如果FDA认为一个用于治疗严重疾病的药物在获得新药批准后,可以对这种疾病治疗的有效性与安全性提供显著改善,则会授予该药物优先审评认定。获得优先审评的新药申请(NDA/BLA),FDA会在6个月内完成审评,与标准审评时间(10个月)相比缩短了4个月。04、加速批准 (Accelerated Approval)
在获批的新药中,有12个(占23%)获得了FDA加速批准。获得加速批准的新药是治疗严重疾病、并且与现有的药物相比具备显著的优势。通过加速批准途径,FDA可以根据预测临床受益的替代终点的临床数据来加快批准新药申请(NDA/BLA)。通过加速批准上市的药物需要进行上市后研究证明临床受益,以支持获得最后的常规批准。05、孤儿药认定 (Orphan Drug Designation, ODD)
孤儿药认定(ODD)是FDA审评申请资料后颁发给符合条件的药物的一种资格认定。孤儿药是指用于预防、诊断或治疗罕见病的药物 (罕见病是指在美国患病人数少于20万的疾病)。2020年FDA CDER批准的53个新药中,有31个新药(占58%)获得了孤儿药认定。获得ODD的药物可以享受政策上相对应的福利。

表1. 2020年CDER 批准的新药获得加快通道及孤儿药认定情况(共计38个)

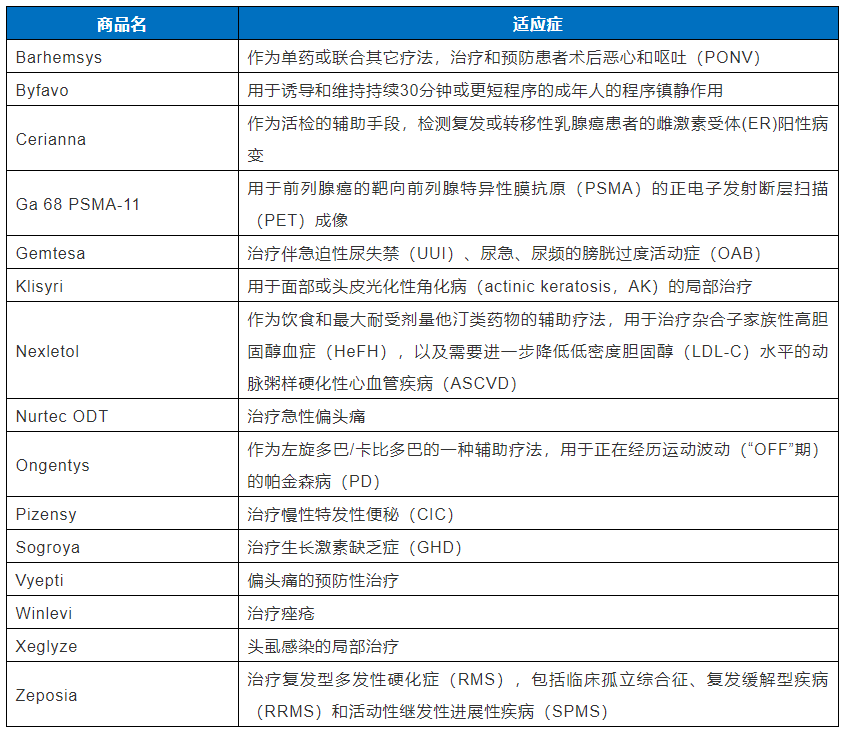
表2. 2020年CDER 批准的新药未获得加快通道或孤儿药认定名单(共计 15个)
信息来源:
[1]. FDA CDER. Advancing Health Through Innovation: New Drug Therapy Approvals 2020, January 2021. https://www.fda.gov/drugs/new-drugs-fda-cders-new-molecular-entities-and-new-therapeutic-biological-products/novel-drug-approvals-2020.[2]. FDA Final Guidance for Industry: Expedited Programs for Serious Conditions-Drugs and Biologics, May 2014.
[3]. FDA Website: Breakthrough Therapy, 01/04/2018. https://www.fda.gov/patients/fast-track-breakthrough-therapy-accelerated-approval-priority-review/breakthrough-therapy.


