FDA
FDA将召开Janssen COVID-19疫苗 EUA申请的专家讨论会
FDA将于美国时间周五(2月26日)召开疫苗与相关生物制品顾问委员会(VRBPAC),针对强生公司旗下的杨森公司(Janssen Biotech, Inc.)申请的新冠肺炎(COVID-19) 疫苗(Ad26.COV2.S)的紧急使用授权(EUA)进行讨论。该疫苗拟用于18岁及以上成人COVID-19的预防。与已获得EUA授权的辉瑞(Pfizer) 和Moderna COVID-19疫苗(mRNA疫苗)不同,该腺病毒载体疫苗拟用于单次肌肉注射(0.5毫升)。根据已有临床试验数据的初步分析,该疫苗对预防无症状感染的也具有一定效力。此外,该疫苗对目前出现的至少一种变异病毒(B.1.351)也显示出了一定效果。根据杨森公司提供的研究数据,该疫苗显示出了良好的保护效力与安全性,有望通过顾问委员会建议EUA的表决,并最终通过FDA的EUA授权。
https://www.fda.gov/advisory-committees/advisory-committee-calendar/vaccines-and-related-biological-products-advisory-committee-february-26-2021-meeting-announcement
FDA发布新指导原则:针对新冠肺炎病毒SARS-CoV-2单克隆抗体药物的研发(包括解决新冠肺炎病毒变种的问题)
2月22日,FDA发布一项新的指导原则《针对SARS-CoV-2病毒的单克隆抗体药物研发,包括解决2019新冠病毒肺炎(COVID-19)公共卫生紧急时期病毒变种的问题》。该指导原则为新药研发公司开发抗SARS-CoV-2病毒的单克隆抗体产品提供了指导性建议。单克隆抗体(monoclonal antibody)是一种免疫球蛋白产品,在人体内可以模拟免疫系统的发挥抵抗有害病原体的作用,比如SARS-CoV-2病毒。目前FDA意识到已经获得EUA授权的单克隆抗体在对抗部分刚出现的SARS-CoV-2病毒变种的生物学活性偏低(有效性降低)。为了应对新冠肺炎病毒新变种,FDA对用于预防或治疗的单克隆抗体药物的EUA授权申请,主要针对非临床、临床、化学、生产与控制等相关方面的要求提供了较为详细的指导性建议。
https://www.fda.gov/regulatory-information/search-fda-guidance-documents/development-monoclonal-antibody-products-targeting-sars-cov-2-including-addressing-impact-emerging?utm_medium=email&utm_source=govdelivery
FDA发布新版指导原则《COVID-19:治疗或预防药品和生物制品的研发》
2月22日,FDA发布了新版《COVID-19:治疗或预防药品和生物制品的研发》指导原则。该指导原则取代了2020年5月发布的相同名称的指导原则。新版的指导原则主要阐述了FDA对于治疗或预防COVID-19的药品和生物制品进行临床II期和III期试验的建议,包括患者人群、试验设计、临床疗效终点以及试验的安全性和统计学考量等。该指导原则的更新,也是FDA为了解决COVID-19新药研发中不断出现的问题采取的一种应对措施之一,包括SARS-CoV-2病毒的变异以及药物上市后COVID-19疫苗的供应。
https://www.fda.gov/media/137926/download?utm_medium=email&utm_source=govdelivery
Regeneron的LIBTAYO®新适应症获批
2月22日,Regeneron Pharmaceuticals, Inc.的Libtayo® (cemiplimab-rwlc)新适应症获FDA批准,用于肿瘤中PD-L1高表达(由FDA批准的测试方法测定肿瘤比例评分【TPS】≥50%,且没有EGFR, ALK or ROS1基因改变)的晚期非小细胞肺癌(NSCLC)患者(转移性或者局部晚期且不适合手术或化疗)的一线治疗。该申请获得了优先审评认定。

https://www.fda.gov/drugs/drug-approvals-and-databases/fda-approves-cemiplimab-rwlc-non-small-cell-lung-cancer-high-pd-l1-expression?utm_medium=email&utm_source=govdelivery
Incyte的JAKAFI®新适应症获FDA优先审评认定
2月22日,Incyte, Inc. 宣布其产品Jakafi®(ruxolitinib)的补充新药申请(sNDA)获FDA优先审评认定,拟用于治疗类固醇难治性慢性移植物宿主病 (GvHD)的成人和12岁及以上的儿童患者。
https://investor.incyte.com/press-releases/press-releases/2021/Incyte-Announces-Acceptance-and-Priority-Review-of-sNDA-for-Jakafi-ruxolitinib-as-a-Treatment-for-Patients-with-Chronic-Graft-Versus-Host-Disease/default.aspx
康方生物Cadonilimab获FDA孤儿药认定
2月23日,康方生物科技(开曼)有限公司宣布其新药PD-1/CTLA-4双特异性抗体cadonilimab获FDA孤儿药认定,用于治疗宫颈癌(除极早期IA1期之外)。

https://portalvhds1fxb0jchzgjph.blob.core.windows.net/press-releases-attachments/1283351/HKEX-EPS_20210223_9629015_0.PDF
NMPA
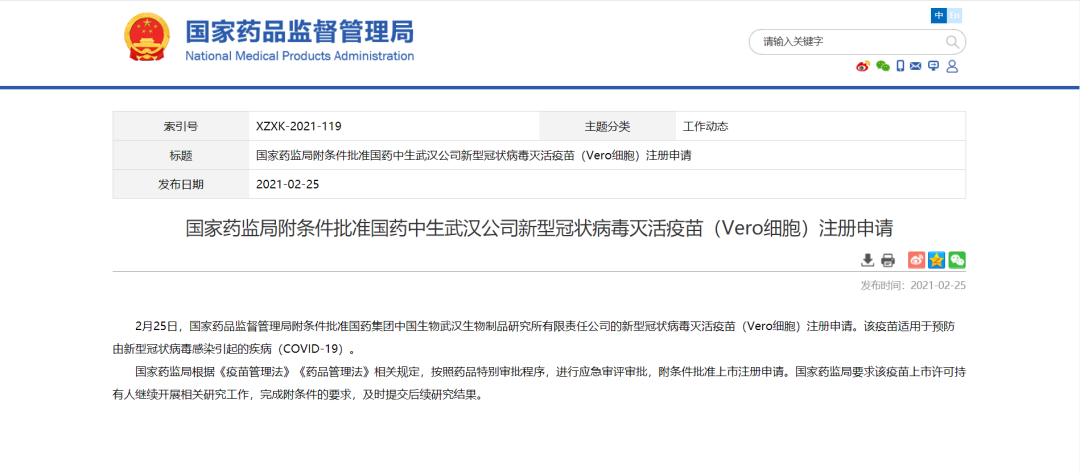
两款新冠疫苗在中国附条件批准上市
2月25日,NMPA公告,附条件批准康希诺生物股份公司重组新型冠状病毒疫苗(5型腺病毒载体)和国药集团中国生物武汉生物制品研究所有限责任公司的新型冠状病毒灭活疫苗(Vero细胞)注册申请。这两款新型冠状病毒疫苗都适用于新型冠状病毒感染引起的疾病(COVID-19)。其中,康希诺的重组新型冠状病毒疫苗(5型腺病毒载体)是首家获批的中国国产腺病毒载体新冠病毒疫苗。
https://www.nmpa.gov.cn/yaowen/ypjgyw/20210225184523188.html
https://www.nmpa.gov.cn/yaowen/ypjgyw/20210225184306142.html
CDE正式发布《药审中心技术审评报告公开工作规范(试行)》
2月23日,根据《国务院关于改革药品医疗器械审评审批制度的意见》和《药品注册管理办法》等相关规定,为进一步落实药品审评审批改革相关要求,深入推进审评信息公开,药审中心发布了《药审中心技术审评报告公开工作规范(试行)》。
http://www.cde.org.cn/news.do?method=viewInfoCommon&id=be24b96a0f22c6a2
浦润奥生物伯瑞替尼纳入拟突破性治疗品种
2月22日,CDE信息公示,北京浦润奥生物科技有限责任公司伯瑞替尼纳入拟突破性治疗品种,拟定适应症为c-Met外显子14突变的非小细胞肺癌。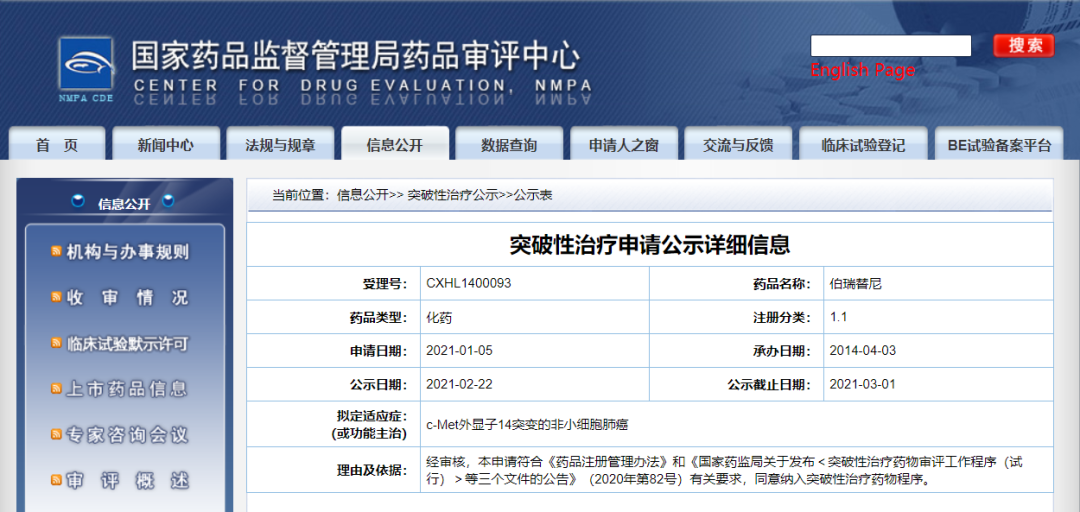
http://www.cde.org.cn/news.do?method=changePage&pageName=service&frameStr=26
安进阿普斯特片纳入拟优先审评品种
2月20日,CDE信息公示,安进生物技术咨询(上海)有限公司阿普斯特片(规格:10mg, 20mg, 30mg)纳入拟优先审评品种,拟定适应症为银屑病。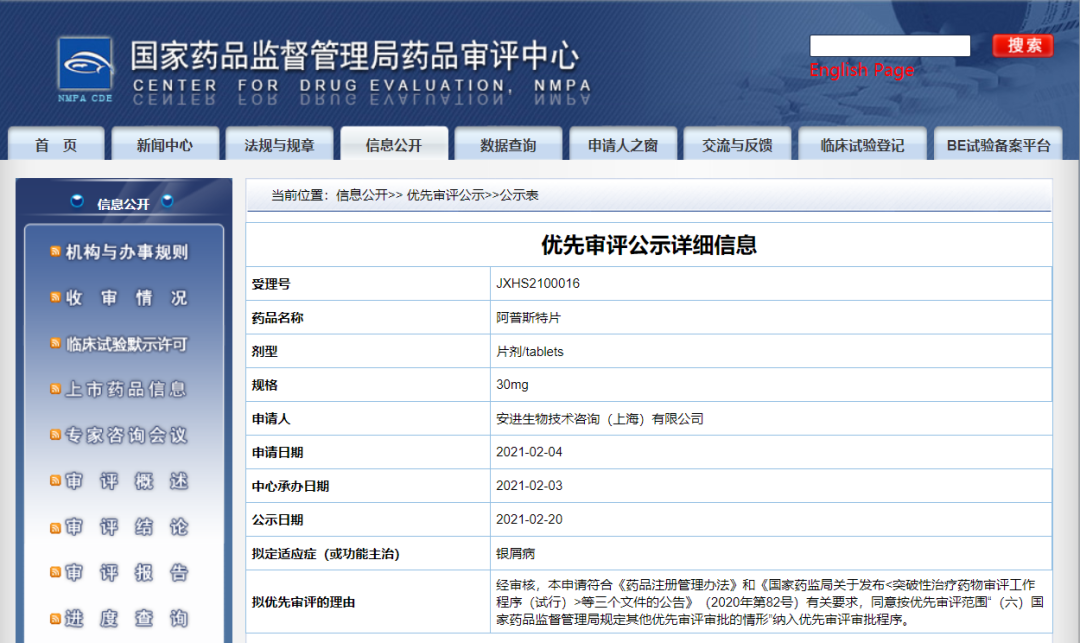
http://www.cde.org.cn/news.do?method=changePage&pageName=service&frameStr


