在上一期专家解读里我们介绍了FDA的紧急使用授权(Emergency Use Authorization, EUA)。自新型冠状病毒肺炎(COVID-19)大流行,FDA已经对许多COVID-19的体外诊断产品、医疗器械、个人防护用品以及药品和生物制品授予了紧急使用授权。在这期专家解读里我们将简要介绍获得FDA紧急使用授权的诊断、治疗和预防COVID-19的产品。

2020年2月4日,美国纽约州卫生部Wadsworth研究中心(CDC)研发的实时RT-PCR诊断平台成为首个获得FDA紧急使用授权的体外诊断产品。至2020年12月28日,FDA已紧急授权了超过300种诊断测试和样本采集器械,其中包括235种分子测试和样品收集装置、63种抗体检测和11种抗原检测。

为了促进潜在的COVID-19治疗的研发,FDA建立了“冠状病毒治疗加速计划”(Coronavirus Treatment Acceleration Program,CTAP)。通过使用FDA掌握的所有资源与工具来确定各种疗法在其预期用途方面的安全性与有效性,从而加快治疗产品的研发。
目前,许多治疗方法尚处于临床试验阶段,评估它们是否能安全、有效地对抗COVID-19。截至2021年1月20日,下列紧急使用授权(EUA)允许特定药品或生物制品用于预防和治疗COVID-19及由COVID-19引起的严重疾病:
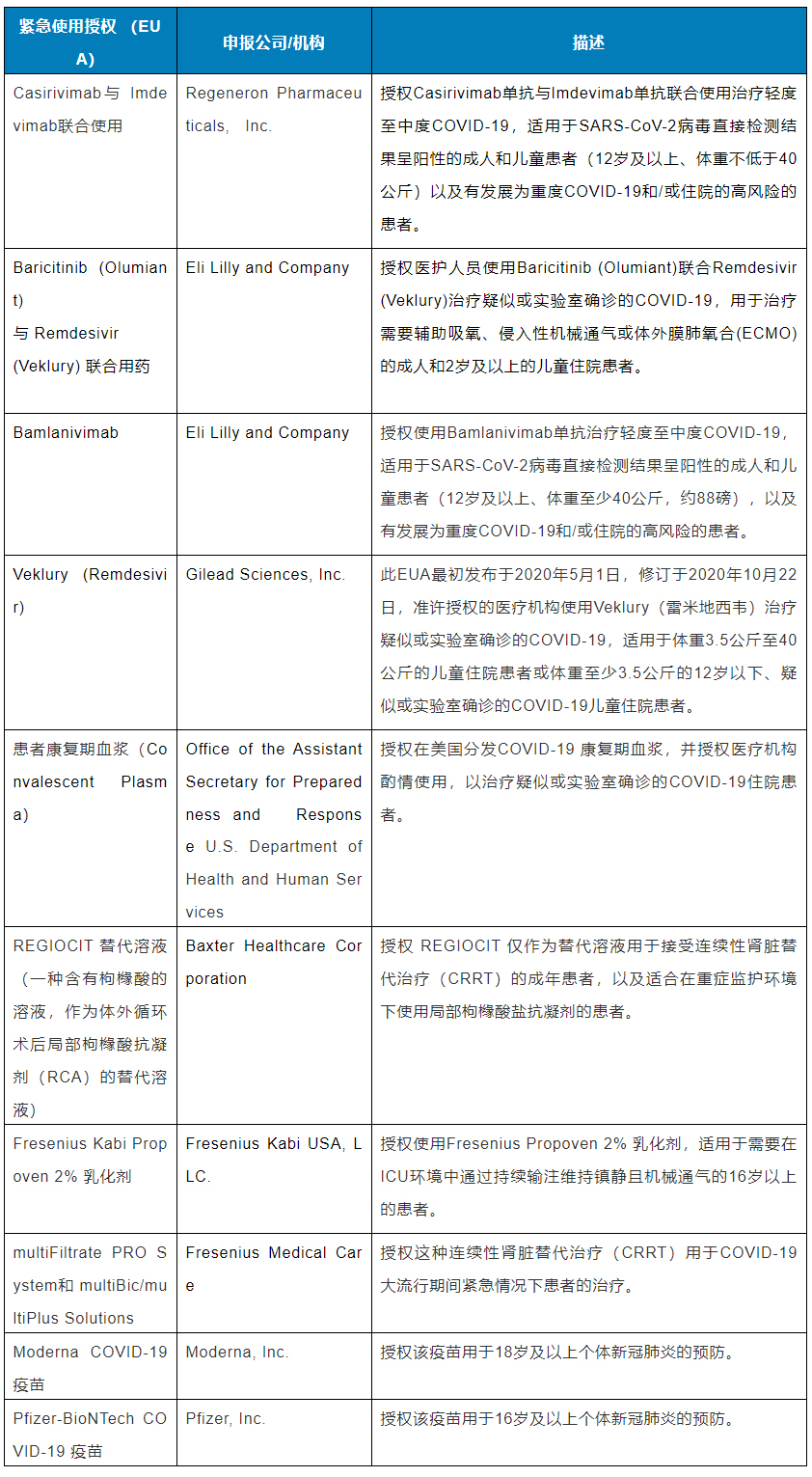
截至2021年1月20日,FDA已经批准了一种治疗COVID-19的药物Veklury (remdesivir)。该抗病毒药物是首个也是唯一获得FDA批准的COVID-19治疗药物,用于需要住院的成人和12岁及以上、体重至少40公斤(约88磅)的儿童患者。据该药物研发公司Gilead报道,Veklury能有效地将COVID-19住院患者的恢复时间缩短5天。Veklury 最初于2020年5月获得过FDA紧急使用授权用于治疗住院患者COVID-19。随后,FDA根据Gilead提交的临床III期研究结果对其有效性与安全性进行严格评估后,认为满足新药审批要求,于2020年10月22日批准了该药的上市申请(NDA)。
信息来源:
[1] https://www.fda.gov/emergency-preparedness-and-response/mcm-legal-regulatory-and-policy-framework/emergency-use-authorization#coviddrugs.[2] FDA Response to COVID-19_English 508_FINAL_Rev(November 2020)
[3] FDA-COVID19-response-at-a-glance(December 2020)
[4] FDA Combating COVID-19 With Therapeutics (December 2020)


