01、什么是紧急使用授权?
紧急使用授权(Emergency Use Authorization, EUA)是一种美国法律机制,可让FDA通过促进在突发公共卫生事件期间所需的医疗产品的可用性,来帮助增强国家针对化学、生物、放射以及核威胁的公共卫生保护。根据美国《联邦食品、药品和化妆品法》(21 USC 360bbb-3)的第564条,FDA可以在符合法定标准,且有科学证据支持使用的前提下,通过EUA允许(a)使用未经批准的医疗产品(例如,药品、疫苗或诊断设备),或(b)扩大已批准产品在尚未获批准的适应症或适用范围的使用,在紧急情况下用于由化学、生物、放射和核威胁引起的严重或危及生命的疾病或状况的诊断、治疗或预防。

02、紧急使用授权的标准
根据FDA于2017年1月颁布的指导原则, 可以考虑EUA的产品包括尚未通过《联邦食品、药品和化妆品法》(505、510(k)和515部分)或《公共卫生服务法》(351部分)批准或许可的产品。EUA产品需要满足下列四条标准:a.严重或威胁生命的疾病或状况 (Serious or Life-Threatening Disease or Condition)
b.有效性证据 (Evidence of Effectiveness)
可以考虑EUA的医疗产品是指“可能有效”诊断、治疗或预防由化学、生物、放射和核威胁引起的严重或危及生命的疾病或状况。EUA的“可能有效”标准所提供的证据水平低于FDA用于产品批准的“有效性”标准。FDA会使用风险收益分析逐案评估可能EUA产品的潜在效力。如果基于现有的全部科学证据合理地认为该产品可能对特定用途有效,并且符合EUA的其他法定标准,FDA可以授予该产品EUA。
c.风险收益分析 (Risk-Benefit Analysis)
如果FDA经评估确定该产品在用于诊断、预防或治疗已确定的疾病或状况时, 其已知和潜在的益处大于该产品已知和潜在的风险,则可以考虑将该产品用于EUA。
在确定产品已知和潜在的益处是否超过其已知和潜在的风险时,FDA会查看所有科学证据以进行整体风险收益评估。此类证据可以有多种来源,包括(但不限于):国内外临床试验的结果、动物模型的体内功效数据以及体外数据。鉴于当前的科学知识水平,FDA还将评估可用证据的质量和数量。
d.没有替代品 (No Alternatives)
FDA考虑EUA产品,当前必须没有足够的已批准和可用的替代品用于诊断、预防或治疗疾病或状况。如果已批准的替代品的供应不足以完全满足紧急需求时,则可能会将潜在的替代产品视为“不可用”。
03、获得紧急使用授权的程序
紧急使用授权的申请和FDA审评新药上市申请(NDA/BLA)是不同的。紧急使用授权由生产商或其他机构根据FDA对相关申请资料的要求向FDA有关部门提出申请。 FDA在收到申请后会根据申请的内容、产品特点及其他一些因素确定优先审评程度,最快可能在数小时或数天内做出决定是否同意紧急使用授权。紧急使用授权是可能被撤消的。FDA有责任定期审查紧急使用授权的适用性,包括审查与紧急使用授权产品相关的新出现的科学数据。例如, FDA在2020年3月28日批准了磷酸氯喹和硫酸羟氯喹的口服制剂用于治疗新型冠状病毒肺炎(COVID-19, 2019冠状病毒肺炎)的紧急使用授权。FDA根据截至该日可获得的科学信息,认为硫酸羟氯喹和磷酸氯喹在用于治疗新型冠状病毒肺炎方面“可能有效”,并且硫酸羟氯喹和磷酸氯喹的已知和潜在益处超过了该用途的已知和潜在风险。随后,FDA根据对硫酸羟氯喹和磷酸氯喹用于治疗新型冠状病毒肺炎的科学证据的持续审查,确定其不再符合《食品、药物和化妆品法》第564(c)(2)节中概述的紧急使用授权法定标准。FDA确定,硫酸羟氯喹和磷酸氯喹不太可能对欧盟批准的新型冠状病毒肺炎治疗有效。此外,鉴于这两种药物临床使用后正在发生的严重心脏不良事件和其他严重副作用,硫酸羟氯喹和磷酸氯喹的已知和潜在益处不再超过其授权使用的已知和潜在风险。根据这一结论,FDA于2020年6月15日撤消了硫酸羟氯喹和磷酸氯喹用于治疗新型冠状病毒肺炎的紧急使用授权。
04、新型冠状病毒肺炎的紧急使用授权
自从2020年2月以来, FDA已经对许多用于新型冠状病毒肺炎(COVID-19, 2019冠状病毒肺炎)的体外诊断产品、医疗器械、个人防护设备以及药物和生物制品授予了紧急使用授权。特别是近日先后发布了用于预防的新冠疫苗紧急使用授权:1)2020年12月11日,Pfizer-BioNTech 的疫苗获FDA紧急使用授权,用于预防16岁及以上人群的2019冠状病毒肺炎。
2)2020年12月18日,Moderna 的疫苗(mRNA-1273)获FDA紧急使用授权,用于预防18岁及以上人群的2019冠状病毒肺炎。
有关上述两个疫苗的紧急使用授权的程序, 请参考FDA颁布的《2019冠状病毒肺炎疫苗从研究到紧急使用授权的路径》 (见下图)。
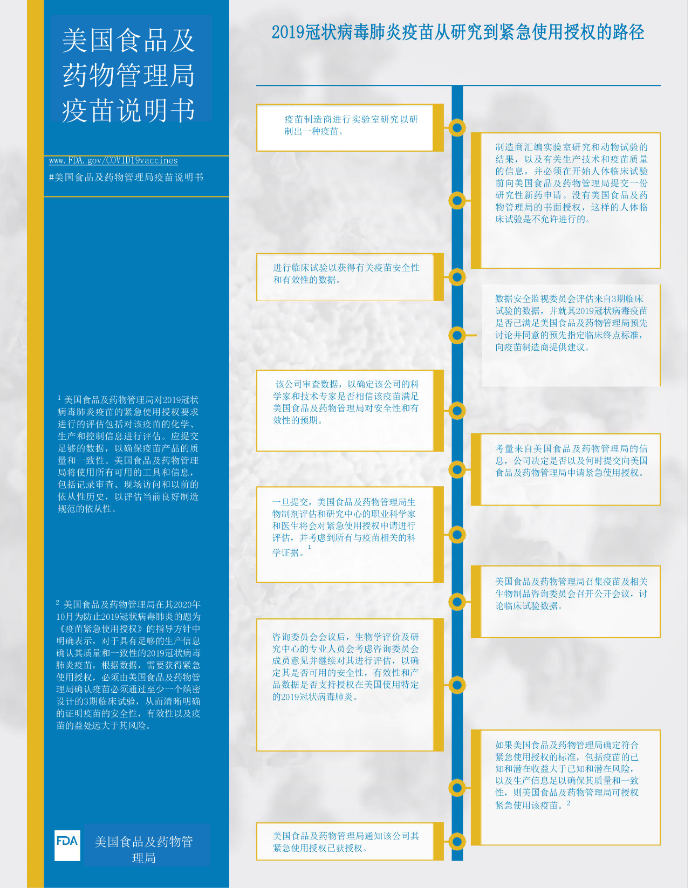
信息来源:
[1] Pandemic and All-Hazards Preparedness Reauthorization Act of 2013 (PAHPRA) Medical Countermeasure (MCM) Authorities: FDA Questions and Answers for Public Health Preparedness and Response Stakeholders (January 2014).[2] FDA Guidance for Industry and Stakeholders: Emergency Use Authorization of Medical Products and Related Authorities(January 2017).
[3] FDA 2019冠状病毒肺炎疫苗从研究到紧急使用授权的路径.


