FDA
Regeneron Pharmaceuticals的PRALUENT®新适应症获批
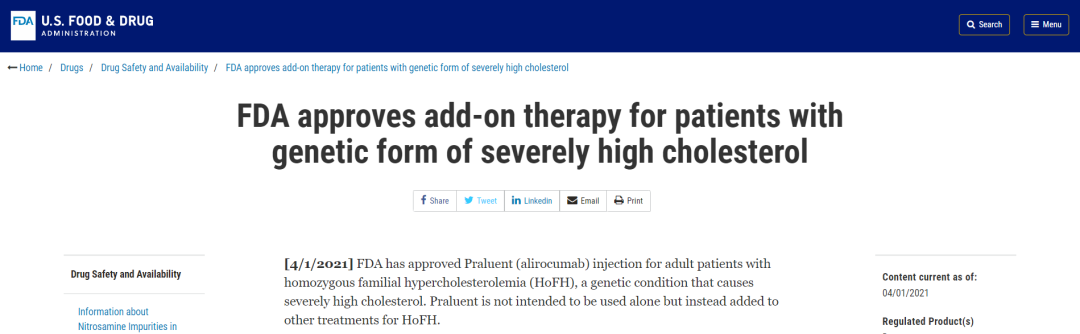
近日,Regeneron Pharmaceuticals, Inc.的Praluent ® (alirocumab)新适应症获得FDA批准,用于治疗纯合子型家族性高胆固醇血症(HoFH)。Praluent ®不单独使用,而是辅助其他HoFH药物进行治疗。
https://www.fda.gov/drugs/drug-safety-and-availability/fda-approves-add-therapy-patients-genetic-form-severely-high-cholesterol-0?utm_medium=email&utm_source=govdelivery
United Therapeutics的TYVASO®新适应症获批
近日,United Therapeutics Corporation的Tyvaso® (treprostinil)新适应症获FDA批准,用于治疗间质性肺病相关的肺动脉高压(PH-ILD),以改善患者运动能力。

https://ir.unither.com/news/press-releases/press-release-details/2021/United-Therapeutics-Announces-FDA-Approval-and-Launch-of-Tyvaso-for-the-Treatment-of-Pulmonary-Hypertension-Associated-with-Interstitial-Lung-Disease/default.aspx
Supernus Pharms的QELBREE™获FDA批准
4月2日,Supernus Pharmaceuticals, Inc.的Qelbree™ (SPN-812)获FDA批准,用于治疗6到17岁儿科患者注意力不足多动症(ADHD)。

https://ir.supernus.com/node/12206/pdf
Taiho Pharma的Futibatinib获FDA突破性治疗认定
4月2日,Taiho Pharmaceutical的Futibatinib (TAS-120) 获FDA突破性治疗认定,用于治疗既往接受过治疗的、携带FGFR2基因重排(包括基因融合)的局部晚期或转移性胆管癌。

https://www.taiho.co.jp/en/release/files/pdf/20210402.pdf
Immunomedics的TRODELVY®获FDA完全批准
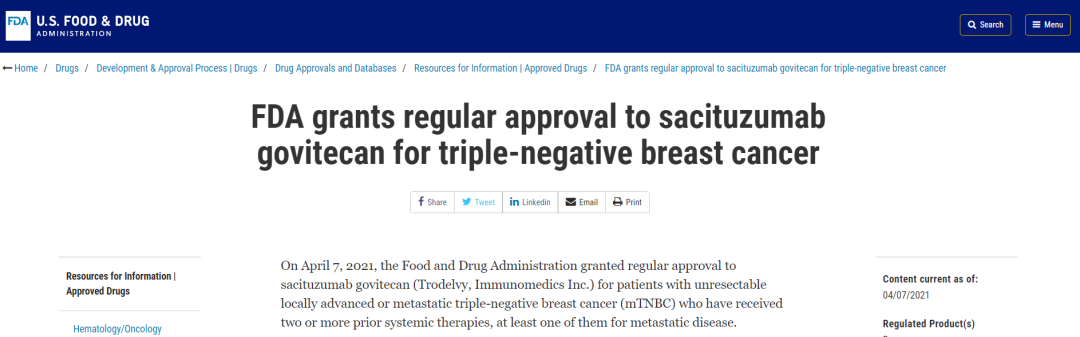
4月7日,Immunomedics Inc.的Trodelvy® (sacituzumab govitecan)获FDA完全批准,用于治疗肿瘤无法切除的局部晚期或转移性三阴性乳腺癌(mTNBC),且这些乳腺癌患者需要既往接受过两种及以上系统治疗(至少有一种方式是针对转移性疾病)。Trodelvy于2020年4月获得FDA加速批准,且曾获得优先审评和突破性治疗认定。
https://www.fda.gov/drugs/resources-information-approved-drugs/fda-grants-regular-approval-sacituzumab-govitecan-triple-negative-breast-cancer?utm_medium=email&utm_source=govdelivery
NMPA
赛沃药业纳曲酮植入剂纳入拟突破性治疗品种
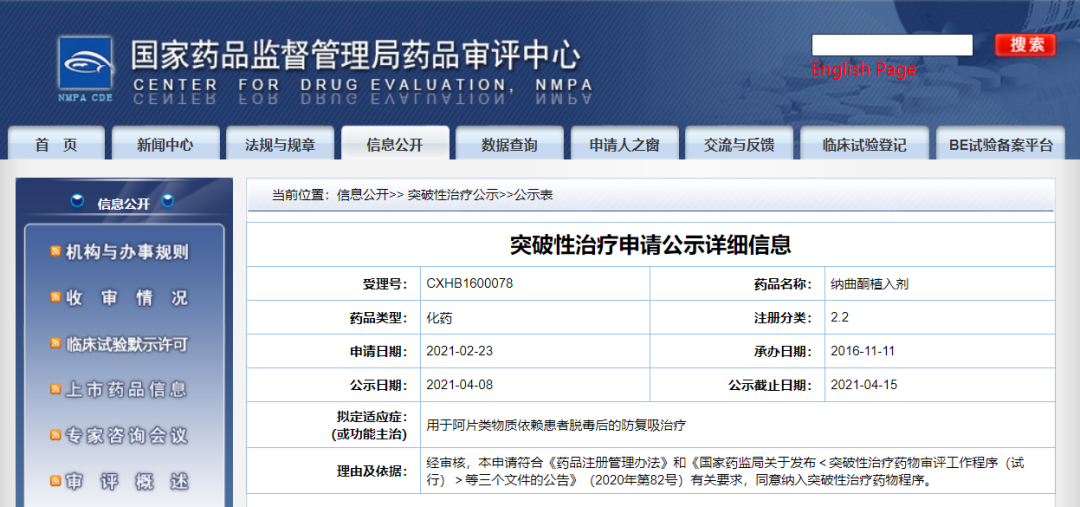
4月8日,CDE信息公示,湖南赛沃药业有限公司的纳曲酮植入剂纳入拟突破性治疗品种,拟用于阿片类物质依赖患者脱毒后的防复吸治疗。
http://www.cde.org.cn/news.do?method=changePage&pageName=service&frameStr=20#
拜耳Copanlisib 注射用冻干制剂纳入拟优先审评品种
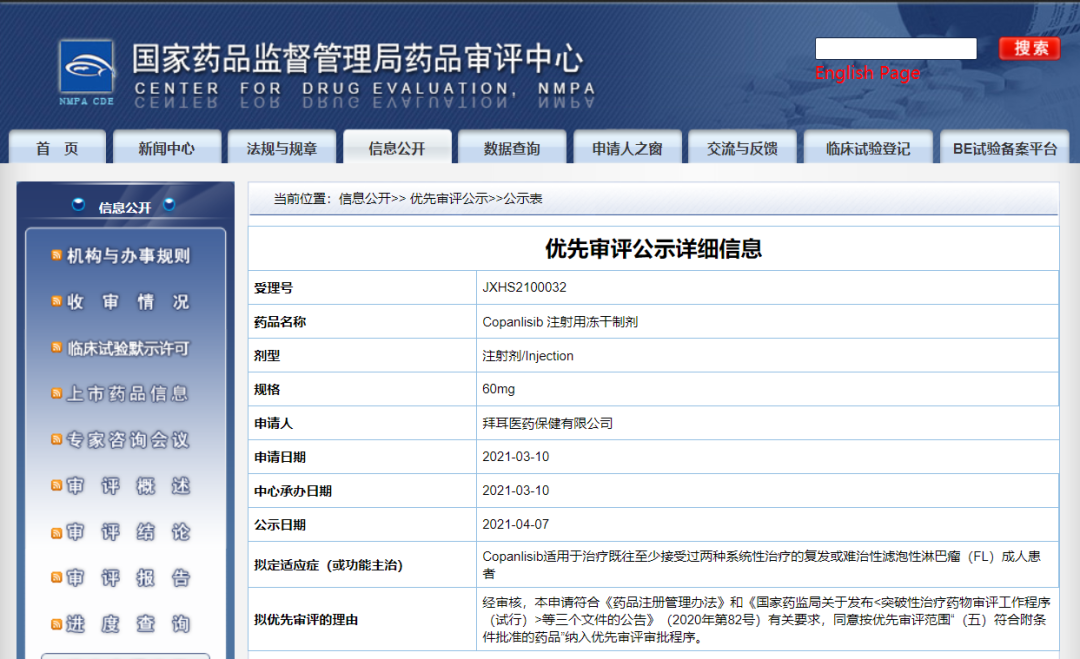
4月8日,CDE信息公示,拜耳医药保健有限公司的Copanlisib 注射用冻干制剂,拟用于治疗既往至少接受过两种系统性治疗的复发或难治性滤泡性淋巴瘤(FL)成人患者。
http://www.cde.org.cn/news.do?method=changePage&pageName=service&frameStr=20#
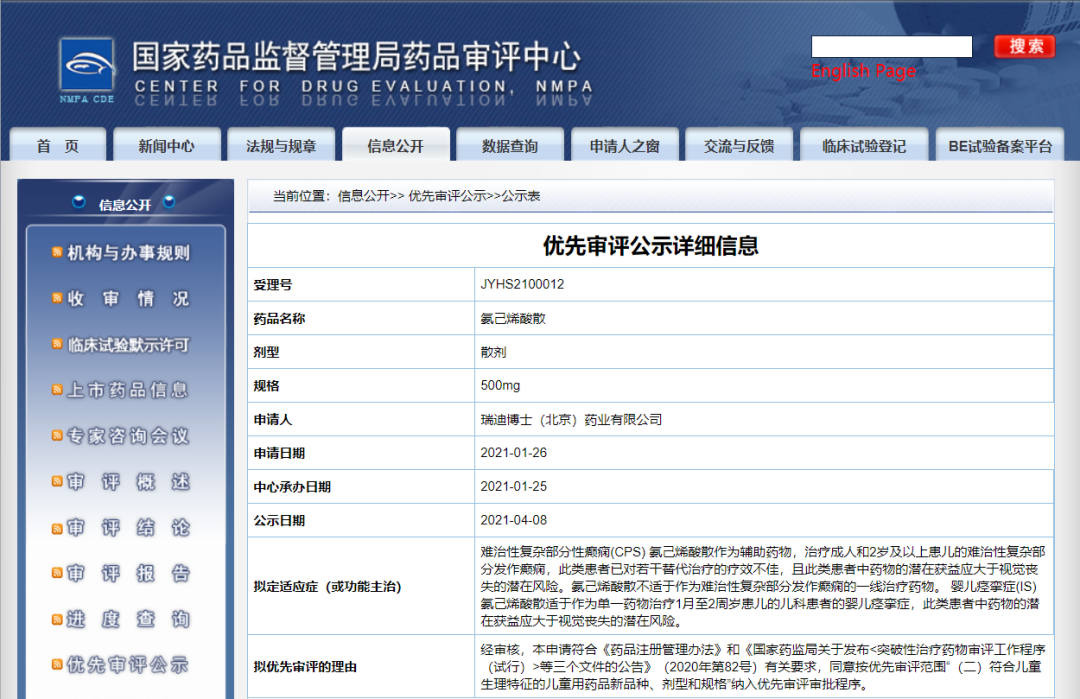
瑞迪博士氨己烯酸散纳入拟优先审评品种
4月8日,CDE信息公示,瑞迪博士(北京)药业有限公司的氨己烯酸散,拟用于作为辅助药物治疗难治性复杂部分性癫痫(CPS)和作为单一药物治疗婴儿痉挛症(IS)。
http://www.cde.org.cn/news.do?method=changePage&pageName=service&frameStr=20#


