FDA
Imcivree™(setmelanotide)获FDA批准成为首个用于特定基因缺陷肥胖症患者体重管理的药物
11月27日,Rhythm Pharmaceutical, Inc.的Imcivree™(setmelanotide)获FDA批准用于六岁及以上肥胖症患者长期体重管理(减重并维持至少一年)。这一类患者的病因主要是三个罕见的由基因变异导致的缺陷:促黑素皮质素( pro-opiomelanocortin, POMC)、前蛋白转化酶枯草溶菌素1(proprotein subtilisin / kexin type 1, PCSK1)、瘦素受体(leptin receptor , LEPR)缺陷。这些缺陷会影响患者的饥饿水平、感受饱腹的能力以及能量代谢,而Imcivree™则通过激活大脑中负责食欲和饱腹感的区域并提高人体静息代谢来达到控制体重的目的。该药物是FDA批准的首个用于治疗这些缺陷导致的肥胖症的药物。Imcivree™获得了孤儿药、突破性疗法以及优先审评认定。

Gallium 68 PSMA-11 (Ga 68 PSMA-11) 获FDA批准成为首个用于前列腺癌的PSMA靶向的PET成像药物
12月1日,由加利福尼亚大学洛杉矶分校和旧金山分校联合研究的Gallium 68 PSMA-11(Ga 68 PSMA-11)获FDA批准,成为首个用于前列腺癌的靶向前列腺癌特异性膜抗原(prostate-specific membrane antigen, PSMA)的正电子发射断层扫描(positron emission tomography, PET)成像药物。Gallium 68 PSMA-11是一种放射性诊断物质,可以发射正电子用于PET成像。通过与前列腺癌细胞中高表达的PSMA结合可对前列腺癌患者体内肿瘤病灶进行定位,从而达到其诊断目的。
https://www.fda.gov/news-events/press-announcements/fda-approves-first-psma-targeted-pet-imaging-drug-men-prostate-cancer?utm_medium=email&utm_source=govdelivery
Pralsetinib获FDA批准用于治疗RET变异甲状腺癌的药物
12月1日,Blueprint Medicines Corporation的Pralsetinib(GAVRETO)获FDA批准用于治疗晚期或转移性RET突变型甲状腺髓样癌(需要全身治疗)或RET融合阳性甲状腺癌(需要全身治疗且对放射性碘耐受)的成人和十二岁及以上的儿科患者。Pralsetinib是一种每日单次口服药物。基于其总体缓解率与缓解持续时间的疗效评估,该药物获得FDA加速批准。Pralsetinib还获得了该适应症孤儿药、突破性疗法以及优先审评认定。

https://www.fda.gov/drugs/drug-approvals-and-databases/fda-approves-pralsetinib-ret-altered-thyroid-cancers?utm_medium=email&utm_source=govdelivery
NMPA
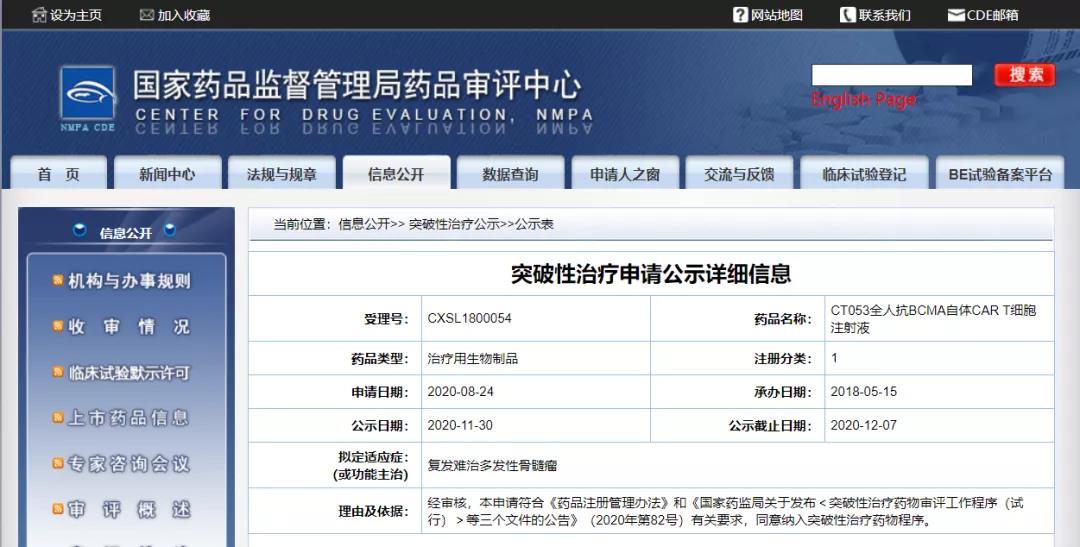
CT053全人抗BCMA自体CAR T细胞注射液获NMPA批准拟纳入突破性治疗药物
11月30日,CDE信息公示,上海科济制药有限公司的CT053全人抗BCMA自体CAR T细胞注射液纳入拟突破性治疗药物,拟定适应症为复发难治多发性骨髓瘤。
http://www.cde.org.cn/news.do?method=changePage&pageName=service&frameStr=26#
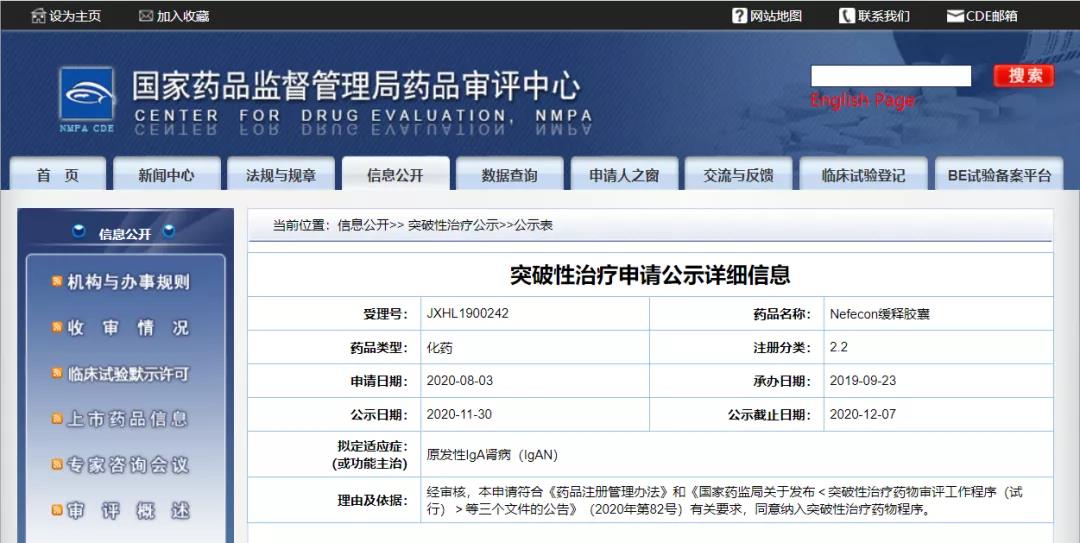
Nefecon缓释胶囊获NMPA批准纳入拟突破性治疗药物
11月30日,CDE信息公示,云屹药业(上海)有限公司的Nefecon缓释胶囊纳入拟突破性治疗药物,拟定适应症为原发性IgA肾病(IgAN)。
http://www.cde.org.cn/news.do?method=changePage&pageName=service&frameStr=26#
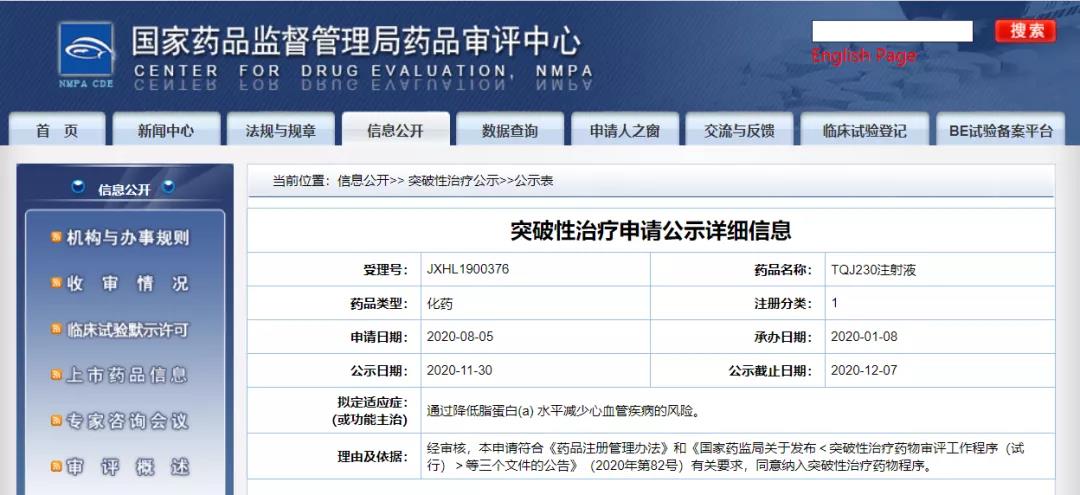
TQJ230注射液获NMPA批准纳入拟突破性治疗药物
11月30日,CDE信息公示,诺华(中国)生物医学研究有限公司的TQJ230注射液纳入拟突破性治疗药物,拟定适应症为通过降低脂蛋白(a)水平减少心血管疾病的风险。
http://www.cde.org.cn/news.do?method=changePage&pageName=service&frameStr=26#
CDE正式发布《GnRH激动剂用于晚期前列腺癌临床试验设计指导原则》
11月30日,为指导我国GnRH激动剂用于晚期前列腺癌的临床研发,提供可参考的技术标准,药审中心组织发布了《GnRH激动剂用于晚期前列腺癌临床试验设计指导原则》,该指导原则自发布之日起施行。
http://www.cde.org.cn/news.do?method=viewInfoCommon&id=ac6f7baaefc7819a
CDE正式发布《晚期肝细胞癌临床试验终点技术指导原则》
11月30日,为指导在我国晚期肝细胞癌中的药物临床研发,提供可参考的技术标准,在国家药品监督管理局的部署下,药审中心组织发布了《晚期肝细胞癌临床试验终点技术指导原则》。

http://www.cde.org.cn/news.do?method=viewInfoCommon&id=a34f2312bc40b6fc
CDE正式发布《单臂试验支持上市的抗肿瘤药上市许可申请前临床方面沟通交流技术指导原则》和《单臂试验支持上市的抗肿瘤药进入关键试验前临床方面沟通交流技术指导原则》
12月3日,为切实鼓励创新,帮助申请人提高与药审中心的沟通交流效率,保证药品审评的科学性和严谨性,保障抗肿瘤创新药以充分科学依据开展关键单臂试验,在国家药品监督管理局的部署下,药审中心组织发布了《单臂试验支持上市的抗肿瘤药上市许可申请前临床方面沟通交流技术指导原则》和《单臂试验支持上市的抗肿瘤药进入关键试验前临床方面沟通交流技术指导原则》。


http://www.cde.org.cn/news.do?method=viewInfoCommon&id=7f76ea2c27986e0b
http://www.cde.org.cn/news.do?method=viewInfoCommon&id=abc0f891082a06b4


