FDA
FDA顾问委员会建议批准Moderna COVID-19疫苗用于紧急使用
经过本周四(12月17日)的全天会议,FDA疫苗和相关生物制品顾问委员会以20票赞成、0票反对、1票弃权,建议对18岁及以上人群进行紧急使用授权(Emergency Use Authorization, EUA)。基于顾问委员会的建议,FDA可能最快于本周五批准Moderna 公司的COVID-19疫苗用于紧急使用。Moderna 的COVID-19疫苗和FDA于12月11日批准的Pfizer-BioNTech COVID-19疫苗都属于mRNA疫苗。
(*根据FDA疫苗和相关生物制品委员会12月17日会议结果和FDA官网内容整理)
https://www.fda.gov/news-events/press-announcements/fda-statement-vaccines-and-related-biological-products-advisory-committee-meeting-0
Pfizer-BioNTech COVID-19疫苗获FDA紧急使用授权
12月11日,Pfizer-BioNTech COVID-19疫苗获FDA紧急使用授权(emergency use authorization, EUA),用于预防16岁及以上人群中由严重急性呼吸综合征冠状病毒2号(SARS-CoV-2)引起的COVID-19。这也是首个获得FDA紧急使用授权的COVID-19疫苗。
https://www.fda.gov/news-events/press-announcements/fda-takes-key-action-fight-against-covid-19-issuing-emergency-use-authorization-first-covid-19
MARGENZA™(margetuximab-cmkb)获FDA批准用于治疗转移性HER2阳性乳腺癌的药物
12月17日,MacroGenics的MARGENZA™(margetuximab-cmkb)获FDA批准与化学疗法联用,用于治疗已接受两种或更多种先前抗HER2方案的转移性HER2阳性乳腺癌成年患者,其中至少一种用于转移性疾病。
https://www.fda.gov/drugs/drug-approvals-and-databases/fda-approves-margetuximab-metastatic-her2-positive-breast-cancer?utm_medium=email&utm_source=govdelivery
Lexicon公司LX9211获FDA快速通道资格认定
12月11日,Lexicon Pharmaceuticals 宣布其LX9211获FDA快速通道资格认定。LX9211是一种高效、选择性口服转接物关联激酶1(AAK1)小分子抑制剂,用于治疗糖尿病周围神经痛。
http://www.lexpharma.com/media-center/news/768-lexicon-pharmaceuticals-receives-fast-track-designation-from-the-fda-for-lx9211-for-diabetic-peripheral-neuropathic-pain
NMPA
CDE正式发布《药物研发与技术审评沟通交流管理办法》
12月11日,CDE信息公示,根据《国家药监局关于实施<药品注册管理办法>有关事宜的公告》(2020年第46号),为推进相关配套规范性文件、技术指导原则起草制定工作,在国家药品监督管理局的部署下,药审中心发布了《药物研发与技术审评沟通交流管理办法》。
http://www.cde.org.cn/news.do?method=viewInfoCommon&id=40e0b5b571f206e1
海正药业海泽麦布片拟纳入优先审评
12月11日,CDE信息公示,浙江海正药业股份有限公司海泽麦布片拟纳入优先审评,拟定适应症为原发性高胆固醇血症,为降血脂药物。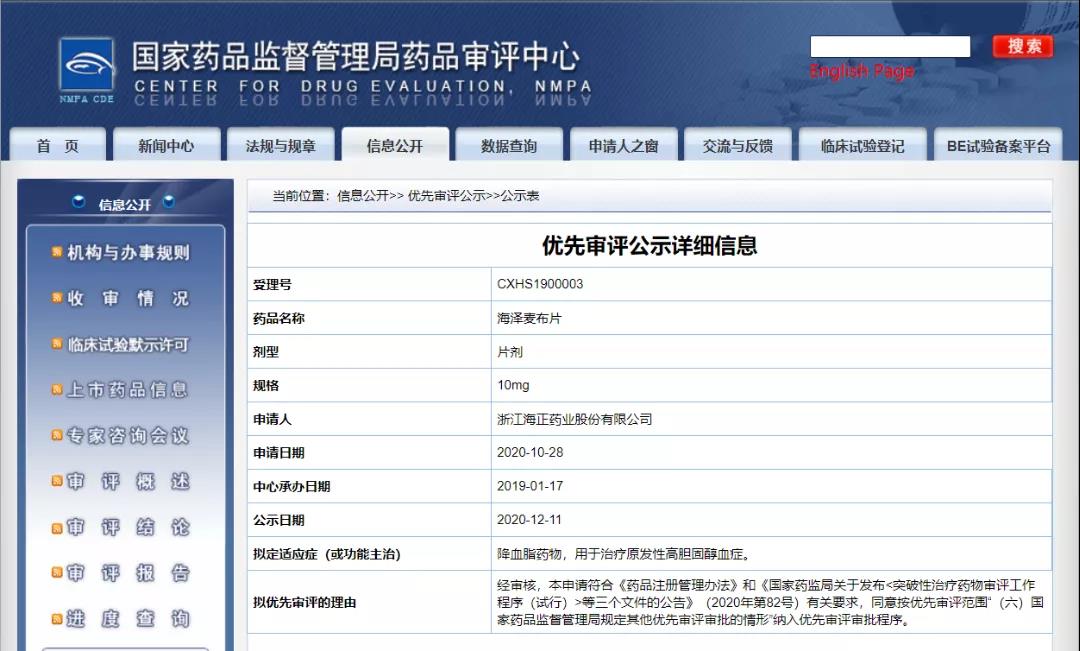
http://www.cde.org.cn/news.do?method=changePage&pageName=service#
合源生物抗CD19嵌合抗原受体T细胞注射液纳入拟突破性治疗药物
12月11日,CDE信息公示,合源生物科技(天津)有限公司抗CD19嵌合抗原受体T细胞注射液纳入拟突破性治疗药物,拟定适应症为复发或难治性急性淋巴细胞白血病。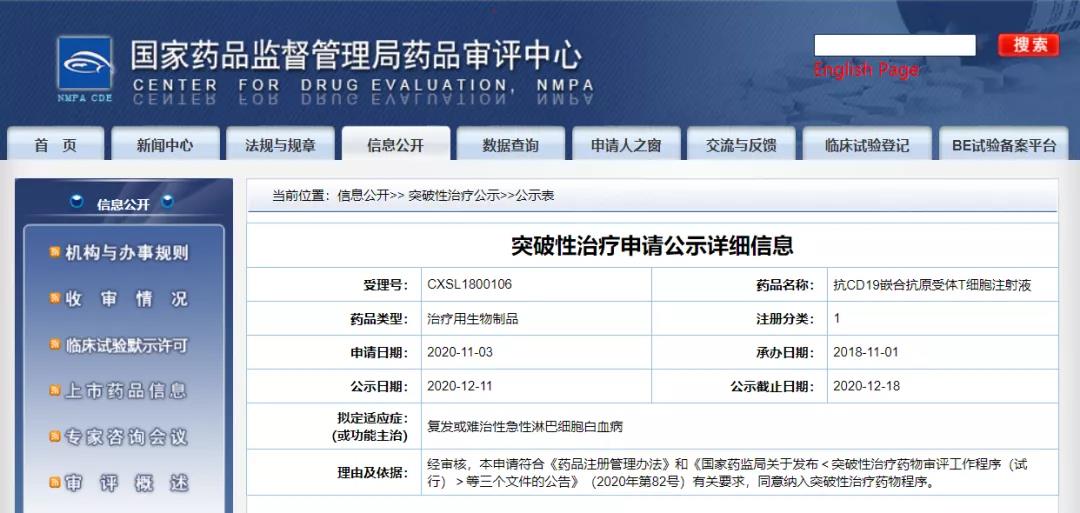
http://www.cde.org.cn/news.do?method=changePage&pageName=service#
辉瑞PF-06651600片纳入拟突破性治疗药物
12月11日,CDE信息公示,辉瑞投资有限公司PF-06651600片纳入拟突破性治疗药物,拟定适应症为≥12岁斑秃患者(包括全秃[AT]和普秃[AU])的治疗。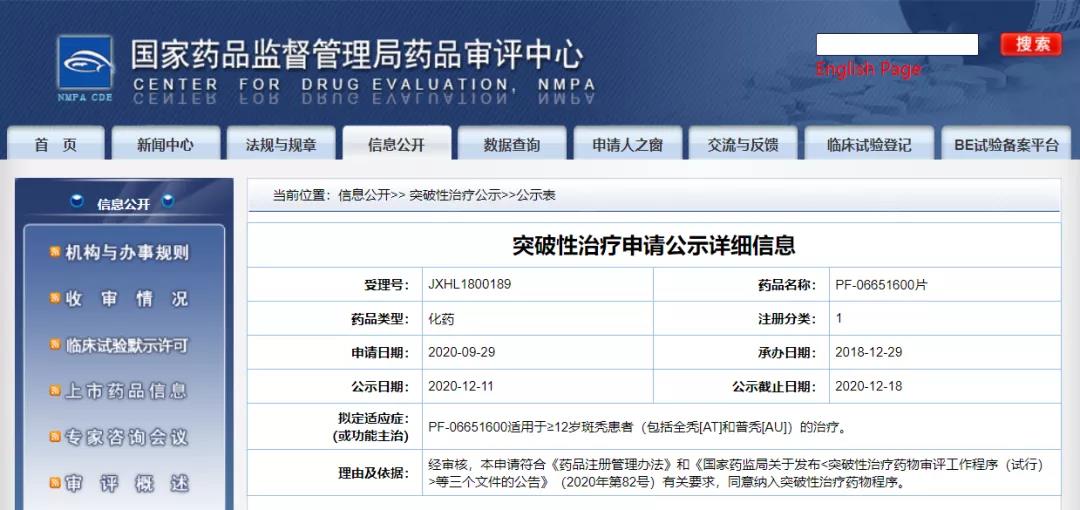
http://www.cde.org.cn/news.do?method=changePage&pageName=service#
烨辉医药BN101片纳入拟突破性治疗药物
12月11日,CDE信息公示,烨辉医药科技(上海)有限公司BN101片纳入拟突破性治疗药物,拟定适应症为至少经过一线系统治疗的慢性移植物抗宿主病(Chronic Graft Versus Host Disease, cGVHD)患者的治疗。
http://www.cde.org.cn/news.do?method=changePage&pageName=service#
默沙东帕博利珠单抗获NMPA批准上市
12月11日,NMPA信息公示,默沙东PD-1抑制剂帕博利珠单抗(商品名:可瑞达®)获批单药用于通过充分验证的检测评估肿瘤表达PD-L1(综合阳性评分(CPS)≥20)的转移性或不可切除的复发性头颈部鳞状细胞癌(HNSCC)患者的一线治疗。该药物是国内首个针对特定晚期头颈部鳞癌患者的一线免疫治疗。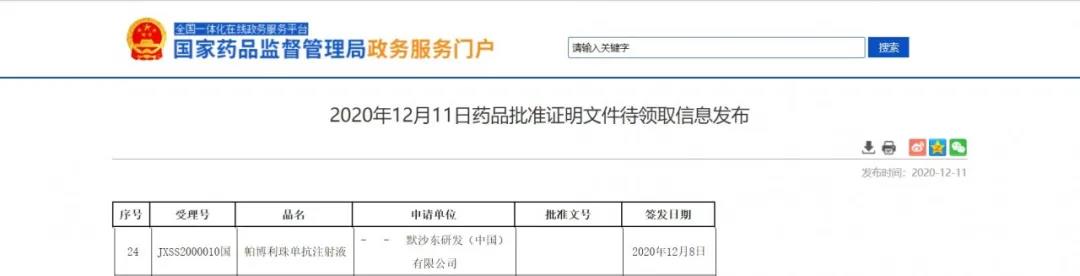
https://www.nmpa.gov.cn/zwfw/sdxx/sdxxyp/yppjfb/20201211093519146.html


